
 �ɻ�ѧ��ת������ܻ����������ʹ�õ�����Ҫ����Դ��
�ɻ�ѧ��ת������ܻ����������ʹ�õ�����Ҫ����Դ������ ��1������ȼ���ȸ�����1mol��ȼ����ȫȼ�������ȶ�������ų����������������������16g�״�ȼ�����ɶ�����̼��Һ̬ˮ���ȣ�����Ȼ�ѧ����ʽ��д��������ע���ʾۼ�״̬�Ͷ�Ӧ�ʱ䣻
��2����Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ��ݴ˼��㣻
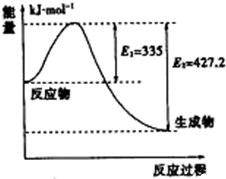
��3������ͼ�����������2mol������Ӧ�ʱ�=���ѻ�ѧ����������-�γɻ�ѧ���ų���������õ�1mol�����ų�������
��4�����ݸ�˹���ɽ���Ȼ�ѧ����ʽ����д��������д��
��� �⣺��1����25�桢101kPa�£�16g�״���CH3OH��ȼ������CO2��Һ̬ˮʱ����352kJ��32g�״�ȼ�����ɶ�����̼��Һ̬ˮ�ų�����Ϊ704KJ�����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-704kJ•mol-1��
�ʴ�Ϊ��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-704kJ•mol-1��
��2��436kJ/mol+243kJ/mol-2E��H-Cl��=-185kJ/mol�����E��H-Cl��=432KJ/mol���ʴ�Ϊ��432KJ/mol��
��3����ͼ��N2��H2��Ӧ����2mol NH3�����������仯ʾ��ͼ����Ӧ�ʱ��H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol����������1mol��������46.1KJ��
�ʴ�Ϊ��46.1 kJ��
��4����֪����2Cu��s��+$\frac{1}{2}$O2��g���TCu2O��s����H=-169kJ•mol-1��
��C��s��+$\frac{1}{2}$O2��g���TCO��g����H=-110.5kJ•mol-1��
��2Cu��s��+O2��g���TCuO��s����H=-314kJ•mol-1
��̿���ڸ��������»�ԭCuO��ȡCu2O��CO�Ļ�ѧ����ʽΪC��s��+2CuO ��s��=Cu��s��+CO��g����
�÷�Ӧ�����Ǣ�-��-$\frac{1}{2}$���٣���Ӧ���ʱ���-110.5kJ•mol-1-��-314kJ•mol-1��-$\frac{1}{2}$����-169kJ•mol-1��=34.5kJ•mol-1��
�ʴ�Ϊ��C��s��+2CuO��s��=Cu2O��s��+CO��g����H=+34.5kJ•mol-1��
���� ���⿼�鷴Ӧ�ȵ��йؼ��㣬��Ŀ�Ѷ��еȣ�ע�����ո��ݸ�˹���ɡ��Ȼ�ѧ����ʽ��ȼ���ȵȽ��еļ��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʱ��t/s | 0 | 50 | 150 | 250 | 350 |
| n��PCl3��/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

| ���� | �е�/�� | �۵�/�� | �ܶȣ�20�棩/��g/cm3�� | �ܽ��� |
| �״� | 64.7 | - | 0.795 | ������ˮ |
| ���� | 34.5 | - | 0.7138 | ������ˮ |
| 3��5-������������ | 172 | 36 | - | �����ڼ״������ѡ�����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ����̼���á��ѳ�Ϊ��ѧ���о�����Ҫ����֮һ��
����̼���á��ѳ�Ϊ��ѧ���о�����Ҫ����֮һ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��һ������ | �縺�� | ������ | �е� |
| O��N | Cl��F | NaCl��CaO | HF��HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
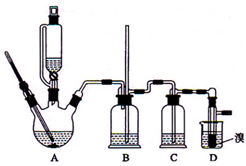 ʵ�����Ʊ�1��2-��������ķ�Ӧԭ���������Ҵ��Ʊ�����ϩ���ٽ���ϩͨ����ˮ�з������·�Ӧ��CH2=CH2+Br2��BrCH2CH2Br�����ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������l40����ˮ�������ѣ�������������������Ҵ��Ʊ�1��2-���������װ����ͼ��ʾ���ش��������⣺
ʵ�����Ʊ�1��2-��������ķ�Ӧԭ���������Ҵ��Ʊ�����ϩ���ٽ���ϩͨ����ˮ�з������·�Ӧ��CH2=CH2+Br2��BrCH2CH2Br�����ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������l40����ˮ�������ѣ�������������������Ҵ��Ʊ�1��2-���������װ����ͼ��ʾ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com