
根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是

 A.c(HCO3—)>c(ClO-)>c(OH-)
A.c(HCO3—)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3—)>c(H+)
C.c(HClO)+ c(ClO-)= c(HCO3—)+ c(H2CO3)
D.c(Na+)+ c(H+)= c(HCO3—)+c(ClO-)+c(OH-)
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:2016届广东省东莞市六校高三上学期联考理综化学试卷(解析版) 题型:选择题
设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
A.88.0g干冰中含有的电子数为8. 0NA
B.常温下,11.2L乙烯在氧气中完全燃烧转移的电子数为6.0NA
C.常温下1.0L0.1mol·L-1NH4Cl溶液中,NH4+和H+总数大于0.1NA
D.1.2g金刚石中含有的碳碳键数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省沈阳市四校协作体高三上学期期中联考化学试卷(解析版) 题型:实验题
某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
装置 | 序号 | 试管中的药品 | 现象 |
持续通入
| 实验Ⅰ | 1.5 mL 1 mol?L-1 CuSO4溶液和3.5 mL 1 mol?L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
实验Ⅱ | 1.5 mL 1 mol?L-1 CuCl2溶液和3.5 mL 1 mol?L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(1)制取新制Cu(OH)2悬浊液的离子方程式为 。
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明: 。检验Cu(OH)2洗涤干净的方法是 。
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3)2+ + Cl- + 2H2O 、 ____________ 。
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:
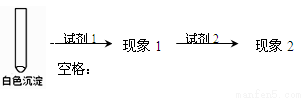
填写下表空格:
试剂1 | 试剂2 | 蒸馏水 | |
现象1 | 现象2 |
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式: 。
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中, _______________ ,则说明砖红色沉淀是Cu2O。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第三次月考化学试卷(解析版) 题型:填空题
“2015.8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)根据价键规则,写出HCN的结构式是 ;
(2)下列能用于判断氮、碳两种元素非金属性强弱的是________。(填序号)
a.气态氢化物沸点
b.最高价氧化物对应水化物酸性强弱
c.Al2O3 + N2 + 3C == 2AlN + 3CO
d.单质晶体类型
(3)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是 ;通过列式计算“c(CN-)与c(HCN)”的大小 判断:c(CN-) c(HCN)(填“>”、“<”或“=”)
(4)含CN﹣的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN﹣氧化成CNO﹣。CNO﹣在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN﹣被处理的百分率。

将浓缩后含CN﹣的废水与过量NaClO溶液的混合液(其中CN﹣浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为 ;乙中反应的离子方程式为 。
②乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN﹣的处理效果.丙中加入的除杂试剂是 (填标号)。
(A)饱和食盐 (B)饱和NaHCO3溶液 (C)浓NaOH溶液 (D)浓硫酸
丁在实验中的作用是 。戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN﹣被处理的百分率 80%(填“>”、“二”或“<”=)。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
维拉左酮是临床上使用广泛的抗抑郁药,其关键中间体合成路线如如:
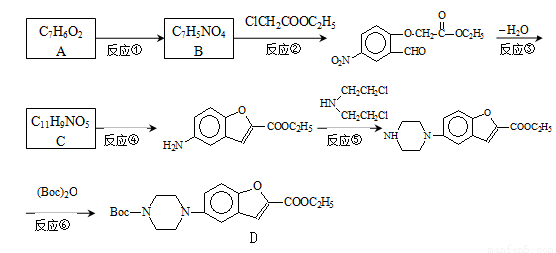
已知:①
②
(1)反应类型:反应④ 反应⑤
(2)结构简式:A C
(3)写出反应②的化学方程式: 。
实验中反应②必须在碳酸钾弱碱性条件下进行的原因是 。
(4)合成过程中反应③与反应④不能颠倒的理由为 。
(5)反应⑥中,(Boc)2是有由两分子C5H10O3脱水形成的酸酐,写出分子式为C5H10O3,且分子中只含有2种不同化学环境氢原子,能发生水解反应的结构简式(书写2种): 、 。
(6)实验室还可以用 和
和 直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式 。
直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建晨曦、冷曦、正曦、岐滨四校高二上联考化学卷(解析版) 题型:实验题
某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1 g固体烧碱样品(杂质不与酸反应)配制成250 mL溶液.
(2)滴定
①用____________量取10.00 mL待测液.
②向锥形瓶中加入几滴酚酞,用0.2010 mol·L-1的标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到______________________时停止滴定.
(3)数据处理
实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
1 | 19.90 | 10.00 |
2 | 20.10 | 10.00 |
3 | 22.00 | 10.00 |
4 | 20.00 | 10.00 |
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为________________,烧碱的纯度为________(保留两位小数)。
(4)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是(多选)( )
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用80 mL的稀盐酸标准溶液,配制时应选用100 mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建晨曦、冷曦、正曦、岐滨四校高二上联考化学卷(解析版) 题型:选择题
下列叙述正确的是
A.常温下,pH值等于14与pH值等于12的两种NaOH溶液等体积混和后,c(H+)=(10-14+10-10)/2
B.常温下,浓度为1×10-10mol/L的KOH溶液的pH值最接近于4
C.氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小
D.常温下,相同温度下pH值等于1的盐酸溶液中水的电离程度与pH值等于13的Ba(OH)2溶液中水的电离程度相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中考试化学试卷(解析版) 题型:选择题
已知下列热化学方程式:
① Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -25kJ·mol-1
② 3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H= - 47kJ·mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
A.Fe3O4 + 4CO = 3Fe + 4CO2 △H= -14kJ·mol-1
B.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g) △H= -22kJ·mol-1
C.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g) △H= +14kJ·mol-1
D.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g) △H= -14kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届湖北省八校高三上学期12月联考理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】
工业上以Al(OH)3、H2SO4、(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如图所示:
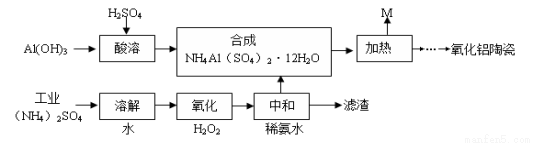
回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为 。
(2)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为 。
NH3·H2O+H+,则该反应的平衡常数为 。
(3)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为 。
(4)固体NH4Al(SO4)2·12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体的成分为 。
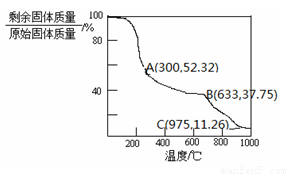
(5)综上分析,流程图中M混合气体的主要成分的化学式为 。M可用一种物质吸收以实现循环利用,该物质的名称是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com