
【题目】在一定温度下,向2L体积固定的密闭容器中加入1molHI, ![]() H>0,H2的物质的量随时间的变化如图所示,下列说法正确的是
H>0,H2的物质的量随时间的变化如图所示,下列说法正确的是

A. 该温度下,恒容时充入HI气体,HI的百分含量增大
B. 0~2min内的HI的平均反应速率为0.05mol·L-1·min-1
C. 恒压下向该体系中加入N2,平衡不移动,反应速率不变
D. 升高温度,平衡向正反应方向移动,只有正反应速率加快
【答案】B
【解析】A.由图可知,平衡时生成氢气为0.1mol,根据方程式计算生成的n(I2)=n(H2)=0.1mol,参加反应的n(HI)=2n(H2)=0.2mol,平衡时HI的物质的量为1mol-0.2mol=0.8mol,由于反应前后气体的化学计量数相等,利用物质的量代替浓度计算平衡常数,故平衡常数k=![]() =
=![]() ,选项A错误;B.由图可知,2min内生成氢气为0.1mol,故v(H2)=
,选项A错误;B.由图可知,2min内生成氢气为0.1mol,故v(H2)=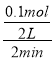 =0.025molL-1min-1,速率之比等于化学计量数之比,故v(HI)=2v(H2)=0.05molL-1min-1,选项B正确;C.恒压下向该体系中加入N2,体积增大,等效为降低压强,该反应前后气体的体积不变,平衡不移动.反应混合物的浓度减小,反应速率减小,选项C错误;D.升高温度正、逆反应速率都增大,正反应速率增大更多,平衡向正反应方向移动,选项D错误。答案选B。
=0.025molL-1min-1,速率之比等于化学计量数之比,故v(HI)=2v(H2)=0.05molL-1min-1,选项B正确;C.恒压下向该体系中加入N2,体积增大,等效为降低压强,该反应前后气体的体积不变,平衡不移动.反应混合物的浓度减小,反应速率减小,选项C错误;D.升高温度正、逆反应速率都增大,正反应速率增大更多,平衡向正反应方向移动,选项D错误。答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O=2HBr+H2SO4,下列说法正确的是( )
A. Br2在反应中表现氧化性
B. SO2在反应中被还原
C. Br2在反应中失去电子
D. 1mol Br2在反应中得到1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A.2.4g金属镁所含电子数目为0.2NAB.16g CH4所含原子数目为NA
C.17gNH3所含中子数目为10 NAD.20g重水(D2O)所含质子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中X和Y均为石墨电极,电解液为滴有酚酞的某浓度NaCl溶液,电解一段时间后,X极附近溶液先变红。下列有关说法中正确的是

A. X极连接电源正极
B. X极上产生气体有刺激性气味
C. Y极上发生氧化反应
D. 电子从X极经过溶液流向Y极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氢氧燃料电池电解苦卤水(苦卤水含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b均为石墨电极),下列有关说法正确的是
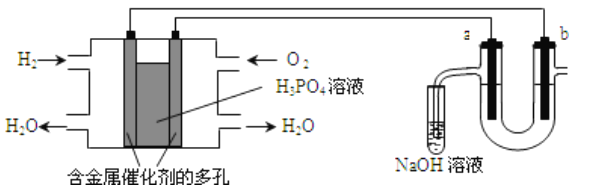
A. 燃料电池工作时,正极反应为:O2+4H++2e-===2H2O
B. 电解时,电子流动的路径是:负极→外电路→阴极→溶液→阳极→正极
C. 忽略能量损耗,当电池中消耗1.12LO2(标准状况)时,b极周围会产生0.1gH2
D. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下表中各物质加横线元素的化合价:
物质 | NH3 | H2O2 | O2 | HClO | SO2 |
化合价 | ________ | ________ | _____ | ________ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。
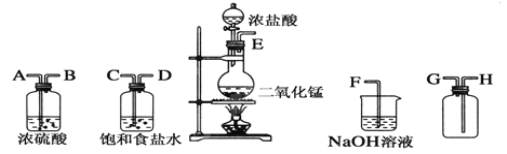
(1)连接上述仪器的正确顺序(填各接口处的字母):E接________;__________接__________;________接________;__________接F。
(2)装置中,饱和食盐水的作用是_____________________________________;浓硫酸的作用是________________________________________________。
(3)化学实验中检验是否有Cl2产生的常用方法是_________________________。
(4)写出下列反应的化学方程式:
①气体发生装置中的反应:_____________________________________。
②NaOH溶液中发生的反应:________________________________________。
(5)工业上用氯气制取漂白粉的化学反应方程式为__________________,漂白粉用于漂白、杀菌的原理用化学方程式表示为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学应用广泛。请回答下列问题:
(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2= 2CuSO4+2H2O,该电池的负极材料为_________;正极的电极反应式为__________________。
(2)燃料电池和二次电池的应用非常广泛。
①如图为甲烷燃料电池的示意图,电池工作时,b极的电极名称为_______;负极的电极反应式为____________;

②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2 + Pb+ 2H2SO4 === PbSO4 + 2H2O,铅蓄电池负极的电极反应式为__________;充电时,铅蓄电池的PbO2极应与外加直流电源的__极相连,PbO2极的电极反应式为_________。
(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应质)时,以硫酸铜溶液为电解质溶液,粗铜做_____极;精炼一段时间后,当阴极增重128 g时,铅蓄电池参加反应的硫酸的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com