
【题目】探究无机盐 X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:

请回答:
(1)X 的化学式是__________。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是__________。
(3)白色沉淀用途广泛,请列举一例:__________。
【答案】 Mg2SiO4 或 2MgO·SiO2 SiO2+2OH-=SiO32-+H2O 优良的阻燃剂等
【解析】无机盐X(仅含三种短周期元素),加入过量盐酸溶解,离心分离得到白色胶状物沉淀和无色溶液,白色胶状沉淀为硅酸,白色沉淀充分灼烧得到白色粉末1.80g为SiO2,物质的量=1.8g÷60g/mol=0.03mol,溶于氢氧化钠溶液得到无色溶液为硅酸钠溶液,说明无机盐中含硅酸根离子或原硅酸根离子,物质的量为0.03mol,若为硅酸根离子其质量=0.03mol×76g/mol=2.28g,金属质量=4.20g-2.28g=1.92g,无色溶液中加入过量氢氧化钠溶液生成白色沉淀则判断为Mg(OH)2,金属离子物质的量=0.06mol,质量为0.06mol×24g/mol=1.44g,不符合,则为原硅酸根,物质的量为0.03mol,质量=0.03mol×92g/mol=2.76g,金属质量4.20g-2.76g=1.44g,物质的量=1.44g÷24g/mol=0.06mol,得到X为Mg2SiO4,则
(1)X的化学式为,Mg2SiO4;(2)白色粉末溶于氢氧化钠溶液的离子方程式是SiO2+2OH-=SiO32-+H2O;(3)氢氧化镁是优良的阻燃剂。


科目:高中化学 来源: 题型:
【题目】有机物M和乙炔可合成![]() 羟基丁酸,
羟基丁酸,![]() 羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C。
羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C。
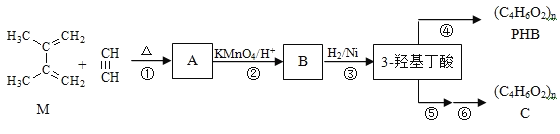
已知:(1).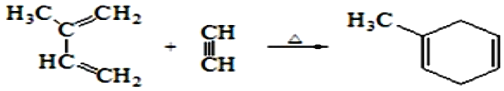
(2)![]()
(3)
(4)C的结构中不含有甲基
![]() A的结构简式为______,B的分子式______。
A的结构简式为______,B的分子式______。
![]() 反应
反应![]() 的反应类型______。
的反应类型______。
![]() 写出反应
写出反应![]() 化学方程式______。
化学方程式______。
![]() 某烃S是
某烃S是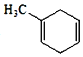 的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,写出烃S可能的结构简式中的其中两种______。
的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,写出烃S可能的结构简式中的其中两种______。
![]() 理论上A也可以由1,
理论上A也可以由1,![]() 丁二烯与烃F来合成,则F的结构简式为______。
丁二烯与烃F来合成,则F的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是
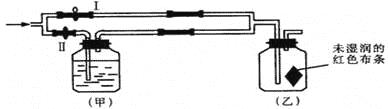
A. 浓H2SO4B. NaOH溶液C. NaCl溶液D. Ca(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
B.Ba(OH)2和H2SO4溶液 混合:Ba2++ SO42- == Ba SO4↓
C.往 NH4HCO3 溶液中加过量的 NaOH 溶液并加热:NH4+OHˉ===NH3↑+H2O
D.向硅酸钠溶液中通入过量的CO2:SiO32-+2CO2 + 2H2O == H2SiO3↓+2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol · L-1NaOH溶液分别滴定20.00mL浓度均为0.1000 mol · L-1CH3COOH 溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是
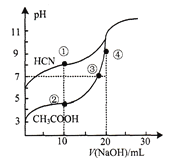
A. 点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-)
B. 点③时:c(Na+)=c(CH3COO-)>c(H+)
C. 点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A.25℃时,pH=3 的 FeCl3 溶液中 H+的数目为 0.001NA
B.甲醛(HCHO)和乙酸的混合物 3.0 g,含有的原子数为 0.4NA
C.0.1 mol SO2 与 1 mol O2 充分反应,转移的电子数为 0.2NA
D.已知白磷(P4)为正四面体结构,NA 个 P4 与 NA 个甲烷所含共价键数目之比为 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]为原料制取六水合氯化镁(MgCl2·6H2O),具体的工艺流程如图:
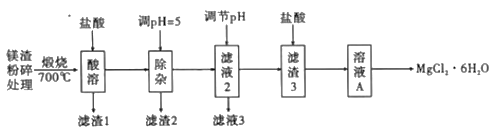
已知:①滤液2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],当x=1,m=0时,碱式氯化镁为Mg(OH)Cl。
②相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下表:
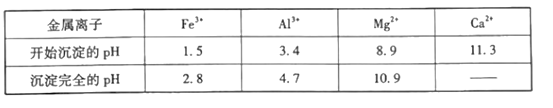
请回答下列问题:
(1)实验室煅烧样品的实验仪器为__。
(2)滤渣2的主要成分是__。
(3)通过调节滤液2的pH来获取Mg(OH)2沉淀,则溶液pH的范围为___。
(4)向溶液A中先加入___(填化学式)酸化,然后___、冷却结晶、过滤、洗涤和低温干燥得到MgCl2·6H2O,取少量低温干燥得到的MgCl2·6H2O晶体溶于水后发现溶液呈碱性,则含有的杂质是__从操作上分析引入杂质的原因是__。
(5)热重分析法是程序控制温度下测最物质的质量与温度关系的一种实验技术。MgCl2·6H2O的热重曲线如图。已知:MgCl2·6H2O在空气中受热脱水时,不产生无水氯化镁。
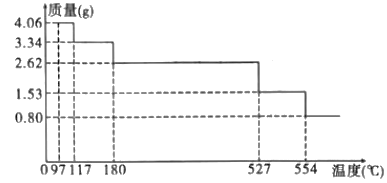
①试确定200℃时固态物质的化学式:___。
②温度升至554℃时分解得到的主要产物为白色固体和一种酸性气体,写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制480mL 0.1 mol/L的Na2CO3溶液,填空并回答下列问题:
(1)配制480mL 0.1 mol/L的Na2CO3溶液。
实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
____________ | ____________ |
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)____________。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1 cm~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
转移溶液后,未洗涤烧杯和玻璃棒就直接定容________;若定容时俯视刻度线__________。
(4)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com