
| A£® | ¢ńŗĶ¢ņĮ½Ķ¾¾¶×īÖÕ“ļµ½Ę½ŗāŹ±£¬ĻµĶ³ÄŚ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»Ķ¬ | |
| B£® | ¢ńŗĶ¢ņĮ½Ķ¾¾¶×īÖÕ“ļµ½Ę½ŗāŹ±£¬ĻµĶ³ÄŚ»ģŗĻĘųĢåµÄ°Ł·Ö×é³É²»Ķ¬ | |
| C£® | “ļµ½Ę½ŗāŹ±¢ńĶ¾¾¶µÄVAµČÓŚ¢ņĶ¾¾¶µÄVA | |
| D£® | “ļµ½Ę½ŗāŗ󣬵Ś¢ńĶ¾¾¶»ģŗĻĘųĆܶČĪŖµŚ¢ņĶ¾¾¶»ģŗĻĘųĆܶȵÄ$\frac{1}{2}$ |
·ÖĪö ÓÉ¢ń£ŗA”¢BµÄĘšŹ¼ÅØ¶Č¾łĪŖ2mol/L£®¢ņ£ŗC”¢DµÄĘšŹ¼ÅØ¶Č·Ö±šĪŖ2mol/LŗĶ6mol/L£¬ĒŅµČĪĀµČČŻĢõ¼ž£¬¢ņÖŠ¼«ŠŌ×Ŗ»ÆŗóĪŖA”¢BŹ±ĪļÖŹµÄĮæ±ČµČÓŚIÖŠA”¢BµÄĪļÖŹµÄĮæ±Č£¬¶žÕßĘ½ŗāµČŠ§£¬ø÷×é³ÉµÄŗ¬Į攢ÅØ¶Č¾łĻąĶ¬£¬½įŗĻM=$\frac{m}{n}$”¢¦Ń=$\frac{m}{V}$·ÖĪö£®
½ā“š ½ā£ŗ¢ńĶ¾¾¶×īÖÕĖł“ļµ½µÄĘ½ŗāÓėCŗĶDµÄĘšŹ¼ÅØ¶Č·Ö±šĪŖ1 mol/LŗĶ3 mol/L×īÖÕĖł“ļµ½µÄĘ½ŗāŹōÓŚµČĶ¬Ę½ŗā£¬ÓÉÓŚøĆĘųĢå·“Ó¦ŹĒŅ»øö·“Ó¦Ē°ŗóĘųĢå×ÜĢå»ż²»±äµÄ·“Ó¦£¬¹Ź¢ņĶ¾¾¶×īÖÕĖł“ļµ½µÄĘ½ŗāÓė¢ńĶ¾¾¶×īÖÕĖł“ļµ½µÄĘ½ŗā£¬æÉŅŌČĻĪŖŹĒ¼ÓŃ¹ŗó²»ŅĘ¶ÆµÄĘ½ŗā£®
A£®¢ńŗĶ¢ņĮ½Ķ¾¾¶×īÖÕ“ļµ½Ę½ŗāŹ±£¬ÓÉM=$\frac{m}{n}$æÉÖŖ£¬ĻµĶ³ÄŚ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæĻąĶ¬£¬¹ŹA“ķĪó£»
B£®¢ńŗĶ¢ņĮ½Ķ¾¾¶×īÖÕ“ļµ½Ę½ŗāŹ±£¬ĻµĶ³ÄŚ»ģŗĻĘųĢåµÄ°Ł·Ö×é³ÉĻąĶ¬£¬¹ŹB“ķĪó£»
C£®ÓÉÓŚ“ļµ½Ę½ŗāŹ±¢ńĶ¾¾¶µÄĪļÖŹµÄĮæÅØ¶ČŹĒ¢ņĶ¾¾¶µÄ$\frac{1}{2}$±¶£¬Ōņ¢ńĶ¾¾¶µÄVAŠ”ÓŚ¢ņĶ¾¾¶µÄVA£¬¹ŹC“ķĪó£»
D£®“ļµ½Ę½ŗāŗ󣬢ńĶ¾¾¶µÄĪļÖŹµÄĮæÅØ¶ČŹĒ¢ņĶ¾¾¶µÄ$\frac{1}{2}$±¶£¬ÓɦŃ=$\frac{m}{V}$æÉÖŖ¢ńĶ¾¾¶»ģŗĻĘųĆܶČĪŖµŚ¢ņĶ¾¾¶»ģŗĻĘųĆܶȵÄ$\frac{1}{2}$£¬¹ŹDÕżČ·£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāŅĘ¶Æ¼°µČŠ§Ę½ŗā£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕĘ½ŗāŅĘ¶ÆµÄÓ°ĻģŅņĖŲ”¢µČŠ§Ę½ŗāµÄÅŠ¶ĻĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬עŅāĘšŹ¼ĪļÖŹµÄĮæÅØ¶Č¹ŲĻµ¼°·“Ó¦µÄĢõ¼ž£¬ĢāÄæÄŃ¶Č²»“ó£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ²Ł ×÷ | ĻÖ Ļó |
| µćČ¼¾Ę¾«µĘ£¬¼ÓČČÖĮ170”ę | ¢ń£ŗAÖŠÉÕĘæÄŚŅŗĢ彄½„±äŗŚ ¢ņ£ŗBÄŚĘųÅŻĮ¬ŠųĆ°³ö£¬ČÜŅŗÖš½„ĶŹÉ« |
| ” | |
| ŹµŃéĶź±Ļ£¬ĒåĻ“ÉÕĘæ | ¢ó£ŗAÖŠÉÕĘæÄŚø½×ÅÉŁĮæŗŚÉ«æÅĮ£×“Īļ£¬ÓŠ“Ģ¼¤ŠŌĘųĪ¶ŅŻ³ö |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
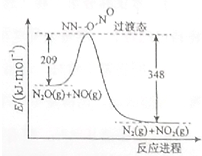 £Ø1£©ĻõĖįļ§¼ÓČČ·Ö½āæɵƵ½N2OŗĶH2O£¬250”ꏱ£¬ĻõĖįļ§ŌŚĆܱÕČŻĘ÷ÖŠ·Ö½ā“ļµ½Ę½ŗā£¬øĆ·Ö½ā·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖNH4NO3$\stackrel{”÷}{?}$N2O+2H2O£¬Ę½ŗā³£Źż±ķ“ļŹ½ĪŖK=c£ØN2O£©”Įc2£ØH2O£©£»ČōÓŠ1molĻõĖįļ§ĶźČ«·Ö½ā£¬×ŖŅʵĵē×ÓŹżĪŖ4mol£®
£Ø1£©ĻõĖįļ§¼ÓČČ·Ö½āæɵƵ½N2OŗĶH2O£¬250”ꏱ£¬ĻõĖįļ§ŌŚĆܱÕČŻĘ÷ÖŠ·Ö½ā“ļµ½Ę½ŗā£¬øĆ·Ö½ā·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖNH4NO3$\stackrel{”÷}{?}$N2O+2H2O£¬Ę½ŗā³£Źż±ķ“ļŹ½ĪŖK=c£ØN2O£©”Įc2£ØH2O£©£»ČōÓŠ1molĻõĖįļ§ĶźČ«·Ö½ā£¬×ŖŅʵĵē×ÓŹżĪŖ4mol£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
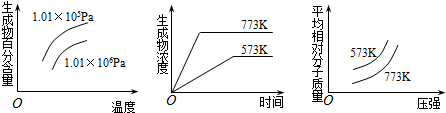
| A£® | N2£Øg£©+3H2£Øg£©?2NH3£Øg£© £ØÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦£© | |
| B£® | 2SO3£Øg£©?2SO2£Øg£©+O2£Øg£© £ØÕż·“Ó¦ĪŖĪüČČ·“Ó¦£© | |
| C£® | 4NH3£Øg£©+5O2£Øg£©?4NO+6H2O£Øg£© £ØÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦£© | |
| D£® | 2HI£Øg£©?I2£Øg£©+H2£Øg£© £ØÕż·“Ó¦ĪŖĪüČČ·“Ó¦£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
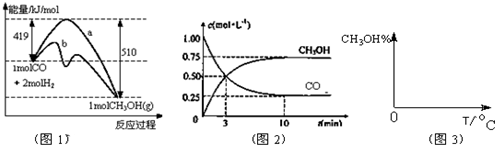
| A£® | ·“Ó¦ĪļČ«²æ×Ŗ»ÆĪŖ¼×“¼ | |
| B£® | Õż·“Ó¦ŗĶÄę·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹ¾łĪŖĮć | |
| C£® | ·“Ó¦ĢåĻµÖŠ¼×“¼µÄ°Ł·Öŗ¬Įæ²»ŌŁ±ä»Æ | |
| D£® | COŗĶH2ŅŌ1£ŗ1µÄĪļÖŹµÄĮæÖ®±Č·“Ӧɜ³É¼××ķ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ca£ØOH£©2 ČÜŅŗ | B£® | ±„ŗĶNaClČÜŅŗ | C£® | ×ŌĄ“Ė® | D£® | NaOHČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com