
【题目】下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
A. 敞口浓硫酸变重B. 敞口浓盐酸变稀
C. 裸露的铝片表面失去光泽D. 氢氧化钠的表面变潮湿
科目:高中化学 来源: 题型:
【题目】已知常温下,0.1molL﹣1的HA溶液中 ![]() =1×10﹣8 , 下列叙述中正确的是( )
=1×10﹣8 , 下列叙述中正确的是( )
A.0.01 molL﹣1HA的溶液中 c(H+)=l×l0﹣4molL﹣1
B.pH=3的HA溶液与pH=ll的NaOH溶液等体积混合后所得溶液中:c(Na+)=c(A﹣)>c(OH﹣)=c(H+)
C.浓度均为0.1 molL﹣1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(H+)﹣c(OH﹣)>c(A﹣)﹣c(HA)
D.pH=3的HA溶液与pH=11的NaOH溶液混合后所得溶液显碱性,则 c(Na+)>c(A﹣)>c(OH﹣)><c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下海带提碘的实验方案可以缩短实验时间,避免Cl2和CCl4的毒性.其实验流程如下: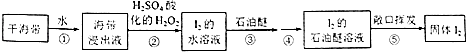
回答下列问题:
(1)步骤①的操作名称是;所需玻璃仪器有玻璃棒、烧杯和 .
(2)步骤②中加入H2O2后发生反应的化学方程式为;选择用H2O2做氧化剂的原因是 .
(3)检验I2的水溶液中含有单质碘的方法是,取样于试管中,加入淀粉,如溶液显色,则可证明含有碘单质.
(4)步骤③的操作名称是;石油醚能用作萃取剂,说明石油醚具有的性质是 .
(5)步骤⑤通过敞口挥发就能得到固体碘,说明石油醚具有良好的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列材料说法不正确是( )
序号 | 材料 | 类别 | 性能 | 用途 |
A | 钛合金 | 金属材料 | 密度小,强度高 | 制飞机机翼 |
B | 普通玻璃 | 硅酸盐材料 | 熔点高,透明 | 制试管、烧杯 |
C | 压电陶瓷 | 半导体材料 | 具有压电效应 | 声纳、地震仪 |
D | 氮化硅陶瓷 | 新型无机非金属材料 | 硬度高,耐磨 | 制发动机 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 ![]() 可简写为
可简写为 ![]() .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: 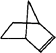
(1)降冰片烯属于 . A 环烃 B 不饱和烃 C 烷烃 D 芳香烃
(2)降冰片烯的分子式为 .
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为 .
(4)降冰片烯不具有的性质 . A 能溶于水 B 能发生氧化反应
C 能发生加成反应 D 常温常压下为气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl﹣、Br﹣
B.常温下 ![]() =12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
=12的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
C.含有大量Al3+的溶液中:Na+、Cl﹣、AlO2﹣、OH﹣
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42﹣、S2﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿浆(主费成分是MnO2)吸收工业要气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外。还含有少量Fe2+、Al3+、Ca2+等金属离子):
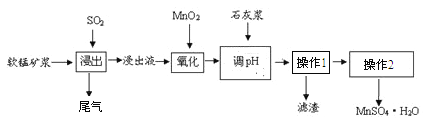
操作1的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
请回答下列问题:
(1)浸出过程中被氧化的物质的化学式为____________________________。
(2)氧化过程中主要反应的离子方程式_________________________________。
(3)在氧化后的液体中加入石灰浆调节pH,pH的范围是_____________________。
(4)操作1的名称是________,操作2包括蒸发浓缩、______过滤、洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200mL溶液。取20.00mL该溶液,向其中逐滴加入0.0500mol/L的FeSO4溶液,发生如下反应:Fe2++Mn3+=Fe3++Mn2+。当反应恰好完全进行时,共消耗FeSO4溶液19.50mL。通过计算确定MnSO4·H2O的纯度(写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,恒压装置中N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ·mol-1,。N2的平衡转化率(
2NH3(g) △H=-92.4kJ·mol-1,。N2的平衡转化率(![]() )与体系总压强(P)的关系如图所示。下列说法正确的是:
)与体系总压强(P)的关系如图所示。下列说法正确的是:

A. 平衡状态由A变到B时,平衡常数K(A)<K(B)
B. 上述反应在达到平衡后,充入He气,H2的转化率减小
C. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
D. 将1mol氮气、3mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com