
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO3,故答案为:>;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:H5IO6<HIO3,故答案为:>;| 7+1-2×2 |
| 2 |


科目:高中化学 来源: 题型:
| A、向燃着的酒精炉中添加酒精 |
| B、在含有大量铝粉尘的车间使用明火 |
| C、金属钠着火时用水灭火 |
| D、氨气泄漏时用湿毛巾捂住口鼻逃生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
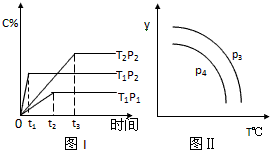
| A、x=2 |
| B、该反应是吸热反应 |
| C、P3>P4,y轴表示B的转化率 |
| D、P3<P4,y轴表示混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食盐既可作调味品也可作食品防腐剂 |
| B、向海水中加入净水剂明矾可以使海水淡化 |
| C、加大石油、煤炭的开采速度,增加化石燃料的供应不利于“蓝天工程”的建设 |
| D、高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 全固态锂硫电池是一种新型电池,其能且密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉.已知锂硫电池的总反应为2Li+S
全固态锂硫电池是一种新型电池,其能且密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉.已知锂硫电池的总反应为2Li+S| 放电 |
| 充电 |
| A、乙池溶液中的N03一移向铁电极 |
| B、乙池石墨电极反应式为Ag++e-=Ag |
| C、甲池充电时,锂电极发生氧化反应 |
| D、甲池中消耗14g锂,乙池中产生11.2L氧气《标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只含一种分子的物质是纯净物,只含一种元素的物质也是纯净物 |
| B、酸的分子式中有几个氢就是几元酸 |
| C、金刚石、石墨、C60互为同素异形体 |
| D、C、N、O三种元素的第一电离能:C<N<O;电负性:C<N<O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18gH2O中含有的质子数为NA |
| B、常温常压下,Na2O2与足量H2O反应,每生成1 molO2,转移电子的数目为4NA |
| C、46gNO2和N2O4混合气体中含有原子总数为3NA |
| D、物质的量浓度为0.5 mol?L-1的MgCl2的溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CS2的比例模型: |
| B、乙醇的结构简式:C2H6O |
| C、核内有8个中子的碳原子:86C |
| D、HClO的结构简式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Al3+、Cl-、OH-(5:1:4:4) |
| B、NH4+、Ba2+、OH-、Cl-(1:1:1:2) |
| C、Fe3+、Na+、Cl-、S2-(2:1:5:1) |
| D、K+、H+、I-、HCO3-( 2:1:1:2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com