
分析 (1)草木灰中的钾盐可以溶于水中形成溶液,可以利用过滤的方法来获得钾盐的水溶液,加热蒸发可得到晶体;
(2)玻璃棒可用于搅拌、引流等作用;
(3)碳酸根离子和盐酸反应产生气体,硫酸根离子和盐酸酸化钡离子反应生成白色沉淀;氯离子和硝酸酸化的银离子反应生成白色沉淀;
(4)根据天平平衡的原理可知,把样品放在右盘,砝码放在左盘,若指针偏向右边,则右边重.
解答 解:(1)草木灰中的钾盐可以溶于水中形成溶液,然后利用过滤的方法可以获得钾盐的水溶液,将所得的水溶液蒸发结晶可以获得氯化钾的固体,
故答案为:过滤;取滤液、蒸发滤液;
(2)在溶解固体时,使用玻璃棒可以加速溶解,在过滤操作中,可以用玻璃棒来引流,在蒸发结晶操作中,用玻璃棒来搅拌,使得受热均匀(防止液体飞溅),
故答案为:加速溶解;引流;使溶液受热均匀,防止液体飞溅;
(3)①碳酸根离子能和盐酸反应生成二氧化碳,向溶液中加入稀盐酸后有气泡生成说明有碳酸根离子,故答案为:气泡;CO32-;
②向原溶液中滴加盐酸酸化的氯化钡溶液,排除了其它阴离子的干扰,如果产生白色沉淀,就说明溶液中有硫酸根离子,故答案为:白色沉淀;SO42-;
③向原溶液中滴加足量稀硝酸后,排除了其它离子的干扰,再加入 AgNO3 溶液,产生白色沉淀,说明溶液中有氯离子,故答案为:白色沉淀;Cl-;
(4)用托盘天平称量样品时,若指针偏向右边,则表示左盘轻、砝码重,故答案为:B.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、离子检验及实验操作等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
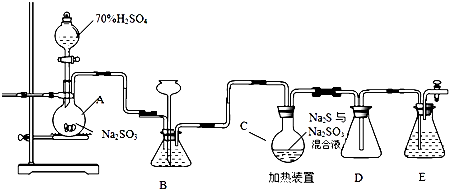
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.
如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是放热反应 | |
| B. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| C. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| D. | 1 mol A2和1 mol B2的总能量高于2 mol AB的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、Na+、Cl- | B. | H+、Na+、NO3-、HCO3- | ||
| C. | Ba2+、H+、NO3-、SO42- | D. | Mg2+、Na+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:
如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com