
(10��)�����£�����Ƭ��ͭƬ����Ƭ(������ɰֽ��ĥ��)�ֱ�Ͷ��Ũ���ᡢŨ���ᡢŨ���ᡢŨ����������Һ�����Լ��У�����12��ʵ�飬ʵ��ı�����±���ʾ��
| Ũ���� | Ũ���� | Ũ���� | Ũ����������Һ |
�� | ʵ��1 | ʵ��2 | ʵ��3 | ʵ��4 |
�� | ʵ��5 | ʵ��6 | ʵ��7 | ʵ��8 |
ͭ | ʵ��9 | ʵ��1O | ʵ��11 | ʵ��12 |
�ش��й�����ʵ����������⣺
(1)���ֽ���Ͷ������ij���Լ��о����������������Լ��� ��
(2)��һ��ʵ������ֱ��֤���������ǿ�����ԣ���ʵ��ı���� ��
(3)��˵��������Ũ����ᷢ�����ۻ��������ʵ���� (��ʵ����)��
(4)����������Һ���ȣ�Ҳ���ᷢ����ѧ��Ӧ��ʵ���� ��12(��ʵ����)��
(5)д��ʵ��4�����Ļ�ѧ����ʽ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(8��)�����£���1.00mol/L�������20.00mL 1.00mol/L��ˮ�У���ҺpH���¶�(0C)
�������������仯��������ͼ��ʾ��
(1)�����й�˵����ȷ����___________
A.a����ˮ�������C(H+)=10-14mol/L
B.b�㣺
C.c�㣺C(Cl-)=C(NH4+)
D.d��������¶����½�����Ҫԭ����NH3��H2O��������
��2���ڵμӹ����У�ˮ�ĵ���̶ȵı仯���� ������ ���������������С�����䡱����
��3�����±��У��ֱ�����������ʵ�����������Ũ�ȵĴ�С˳��Ӧ���ʵĻ�ѧʽ��
��Һ��pH������д���пհף�
|
| ����Ũ�ȵĹ�ϵ | ���� | ��Һ��pH | �����غ��ϵ |
| �� | C��NH4+����C��Cl-����C��OH-����C��H+�� |
| pH��7 | / |
| �� |
| NH4Cl | / |
|
| �� | C��Cl-����C��H+����C��NH4+����C��OH-�� |
| pH��7 | / |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��2011ѧ���㽭ʡ����ѧ����ѧ�߶���ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
(10��)
��A���ʵĻ�ѧʽΪM(OH)2����������ˮ�Ƴ�ϡ��Һ������Һ�����ԣ�����Һ�д��ڣ�
M2+ + 2OH- M(OH)2
M(OH)2 2H+ + MO22-
2H+ + MO22-
�ش�������Ŀһ���á�������С�������䡱���
��1���������������������£�25Coʱ��������ˮ�м���A���ʺ������ǰ�Ƚϣ�
����ˮ�������C(OH-) ��C(H+) ��ˮ�ĵ���� ��Kw
��2����4�֣�25Coʱ����A��ϡ��Һ�м����������ռ���塣
��ˮ�ĵ���� ����Һ��pH
��.(2��)�����£��ס�����ƿ��ˮ��Ũ�ȷֱ�Ϊ1mol/L��0.1mol/L,��ס�����ƿ��ˮ��C(OH-)֮��Ϊ 10 (����ڡ����ڻ�С��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ�ϲ����и߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
(8��)�����£���1.00mol/L�������20.00mL 1.00mol/L��ˮ�У���ҺpH���¶�(0C)
�������������仯��������ͼ��ʾ��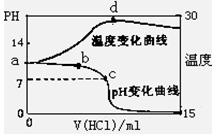
(1)�����й�˵����ȷ����___________
A.a����ˮ�������C(H+)=10-14mol/L
B.b�㣺
C.c�㣺C(Cl-)=C(NH4+)
D.d��������¶����½�����Ҫԭ����NH3��H2O��������
��2���ڵμӹ����У�ˮ�ĵ���̶ȵı仯���� ������ ���������������С�����䡱����
��3�����±��У��ֱ�����������ʵ�����������Ũ�ȵĴ�С˳��Ӧ���ʵĻ�ѧʽ��
��Һ��pH������д���пհף�
| | ����Ũ�ȵĹ�ϵ | ���� | ��Һ��pH | �����غ��ϵ |
| �� | C��NH4+����C��Cl-����C��OH-����C��H+�� | | pH��7 | / |
| �� | | NH4Cl | / | |
| �� | C��Cl-����C��H+����C��NH4+����C��OH-�� | | pH��7 | / |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
(8��)�����£���1.00mol/L�������20.00mL 1.00mol/L��ˮ�У���ҺpH���¶�(0C)
�������������仯��������ͼ��ʾ��

(1)�����й�˵����ȷ����___________
A.a����ˮ�������C(H+)=10-14mol/L
B.b�㣺
C.c�㣺C(Cl-)=C(NH4+)
D.d��������¶����½�����Ҫԭ����NH3��H2O��������
��2���ڵμӹ����У�ˮ�ĵ���̶ȵı仯���� ������ ���������������С�����䡱����
��3�����±��У��ֱ�����������ʵ�����������Ũ�ȵĴ�С˳��Ӧ���ʵĻ�ѧʽ��
��Һ��pH������д���пհף�
|
|
����Ũ�ȵĹ�ϵ |
���� |
��Һ��pH |
�����غ��ϵ |
|
�� |
C��NH4+����C��Cl-����C��OH-����C��H+�� |
|
pH��7 |
/ |
|
�� |
|
NH4Cl |
/ |
|
|
�� |
C��Cl-����C��H+����C��NH4+����C��OH-�� |
|
pH��7 |
/ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com