
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 使用分液漏斗和容量瓶时,首先要查是否漏水 | |
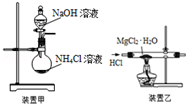
| C. | 实验室用装置甲制取NH3 | |
| D. | 用装置乙制取无水MgCl2 |
分析 A.用稀盐酸洗净铂丝并灼烧至火焰为无色,可排除干扰;
B.具有活塞或塞子的仪器使用前需要检查是否漏液;
C.氯化铵溶液和稀的NaOH反应生成一水合氨而得不到氨气;
D.氯化镁易水解生成HCl和氢氧化镁,HCl能抑制氯化镁水解.
解答 解:A.用稀盐酸洗净铂丝并灼烧至火焰为无色,可排除其它杂质的干扰,操作合理,故A正确;
B.具有活塞或塞子的仪器使用前需要检查是否漏液,则使用分液漏斗和容量瓶时,都要首先检查是否漏水,故B正确;
C.氯化铵溶液和稀的NaOH反应生成一水合氨而得不到氨气,如果想得到氨气,应该加热,故C错误;
D.氯化镁易水解生成HCl和氢氧化镁,在HCl氛围中加热二水氯化镁能抑制氯化镁水解,从而得到无水MgCl2,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、焰色反应、仪器使用等知识点,明确实验原理、实验操作、仪器使用方法是解本题关键,侧重考查学生分析判断及实验操作能力,易错选项是C,注意:如果不加热应该用NaOH固体或浓的NaOH溶液,题目难度不大.


科目:高中化学 来源: 题型:解答题
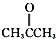 ③CH3CH2Br ④
③CH3CH2Br ④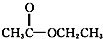 ⑤
⑤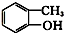
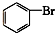 ⑦
⑦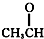 ⑧
⑧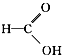 ⑨
⑨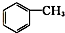 ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
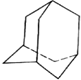 某些石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
某些石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ;含有的化学键类型有离子键和共价键.
;含有的化学键类型有离子键和共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
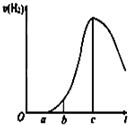 某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.
某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
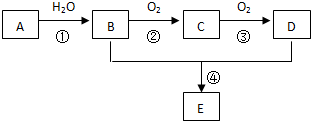
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的氨水与氯化铵溶液中,前者c(NH${\;}_{4}^{+}$)大 | |
| B. | CH3COONa溶液中滴加少量浓盐酸后,水电离程度增大 | |
| C. | 向Na2CO3溶液中加入NaOH溶液后,c(CO${\;}_{3}^{2-}$)增大 | |
| D. | 室温时AgCl分别加入水中与AgNO3溶液中,前者溶度积常数大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com