
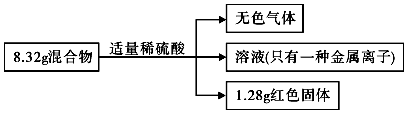
| A. | 无色气体的体积为2.24L | |
| B. | 原混合物中铁的质量为6.72g | |
| C. | 反应后的溶液中金属离子物质的量为0.02 mol | |
| D. | 反应消耗的H2SO4物质的量为0.1 mol |
分析 生成可燃性气体,说明发生反应:Fe+H2SO4=FeSO4+H2↑,得到的溶液只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,根据Cu的质量计算CuO质量,进而计算Fe的质量,根据电子转移计算生成氢气的质量,根据硫酸根守恒可知n反应(H2SO4)=n(FeSO4),再由Fe原子守恒可知n反应(H2SO4)=n(FeSO4)=n(Fe),以此解答该题.
解答 解:生成可燃性气体,说明发生反应:Fe+H2SO4=FeSO4+H2↑,溶液为浅绿色,只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,生成1.28gCu,n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.02mol,故混合物中m(CuO)=0.02mol×80g/mol=1.6g,则m(Fe)=8.32g-1.6g=6.72g,n(Fe)=$\frac{6.72g}{56g/mol}$=0.12mol,
A.设氢气的物质的量为nmol,根据电子转移守恒,由2n+0.02mol×2=0.12mol×2,解得n=0.1mol,但由于气体存在的条件位置,则不能确定体积,故A错误;
B.通过以上分析知,Fe的质量为6.72g,故B正确;
C.根据硫酸根守恒可知n反应(H2SO4)=n(FeSO4),再由Fe原子守恒,可知n反应(H2SO4)=n(FeSO4)=n(Fe)=0.12mol,故C错误;
D.溶液中金属离子是亚铁离子,根据Fe原子守恒得n(Fe2+)=n(Fe)=0.12mol,故D错误;
故选B.
点评 本题考查混合物的计算,为高频考点,题目难度中等,侧重考查学生分析判断能力,明确物质之间反应及反应先后顺序是解本题关键,注意原子守恒、转移电子守恒的灵活运用.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中一定不含Fe3+ | B. | 溶液中一定含Fe2+ | ||
| C. | 溶液中一定不含Cu2+ | D. | 剩余固体中一定含Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应正反应是放热反应 | |
| B. | 该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0 | |
| C. | 在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100 | |
| D. | 工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅可用于制造光导纤维 | |
| B. | 盛氢氧化钠溶液的试剂瓶不能用玻璃塞 | |
| C. | 氯气可用于制取漂白粉 | |
| D. | 氢氧化铝可用于制造中和胃酸的药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸 | B. | 乙醇 | C. | 甲醛 | D. | 葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
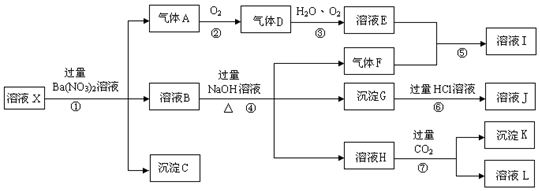
 ,实验中,可以观察到反应②的现象是:无色气体变为红棕色.
,实验中,可以观察到反应②的现象是:无色气体变为红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水和酸性高锰酸钾溶液褪色原理相同 | |
| B. | 乙烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为 120° | |
| C. | 除去乙烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙烯和环丙烷( 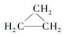 )的分子组成符合通式 CnH2n,因此它们属于同系物 )的分子组成符合通式 CnH2n,因此它们属于同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com