
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点(℃) | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
 σ
σ分析 (1)由表中电离能可知,二者第三电离能都剧增,原子最外层电子数为2,都为短周期元素,A和B单质燃烧时均放出大量热,可用作燃料,同主族自上而下第一电离能降低,故A为铍、B为Mg,镁是12号元素,BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对;
(2)配合物由内界和外界组成,配合物溶于水发生电离生成内界离子(络离子)和外界离子,加入AgNO3溶液时,无明显现象,说明溴离子为配合物的内界配体,加BaCl2溶液时若,产生白色沉淀,说明硫酸根离子为外界离子,据此书写配离子化学式,根据配体的数目可确定中心离子的配位数;
(3)离子晶体中离子的半径越小,离子键强度越大,熔点越高,所以钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的半径有关,随着半径的增大,熔点逐渐降低;
(4)分子晶体的熔点与共价键的键能无关,与分子间作用力有关,根据晶胞的结构,利用均摊法计算出每个晶胞结构各离子的个数;
(5)根据三聚氰胺分子中氮原子成键特点判断杂化方式,每个共价键中有且仅有一个是σ键,据此判断σ键的数目;
(6)根据均摊法计算晶胞中C、Si原子数目,进而计算晶胞中含有C、Si原子总体积,计算晶胞的体积,晶胞的空间利用率=$\frac{晶胞中C、Si原子总体积}{晶胞体积}$×100%.
解答 解:(1)由表中电离能可知,二者第三电离能都剧增,原子最外层电子数为2,都为短周期元素,同主族自上而下第一电离能降低,故A为铍、B为Mg,镁的基态原子核外电子排布式为1s22s22p63s2,BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型,
故答案为:1s22s22p63s2;直线型;
(2)配合物由内界和外界组成,配合物溶于水发生电离生成内界离子(络离子)和外界离子,加入AgNO3溶液时,无明显现象,说明溴离子为配合物的内界配体,加BaCl2溶液时若,产生白色沉淀,说明硫酸根离子为外界离子,所以该配合物的化学式为[Co(Br)(NH3)5]SO4,根据配体的数目可知中心离子的配位数为6,
故答案为:[Co(Br)(NH3)5]SO4;6;
(3)离子晶体中离子的半径越小,离子键强度越大,熔点越高,所以钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的半径有关,随着半径的增大,熔点逐渐降低;
故答案为:随阴阳离子的半径增大,熔降低点;
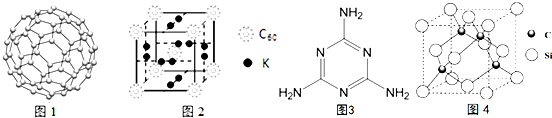
(4)尽管C60中C-C键的键能可能大于金刚石,但其熔化时并不破坏化学键,因此比较键能没有意义,根据晶胞的结构,利用均摊法可知,在晶胞中K原子和C60分子的个数比为$\frac{12}{2}$:($8×\frac{1}{8}$+1)=3:1,
故答案:不正确,C60是分子晶体,熔化时不需破坏化学键;3:1;
(5)三聚氰胺分子中处于环上的N原子成3个σ键,没有孤电子对,采取sp2杂化,氨基中N原子成2个σ键,含有1对孤电子对,N原子采取sp3杂化,单键为σ键,双键含有1个σ键、1个π键,故1个三聚氰胺分子含有15个σ键,则1mol三聚氰胺分子中σ键的数目为15NA,
故答案为:sp2、sp3;15;
(6)根据均摊法计算晶胞中C原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、Si原子数目=4,晶胞边长为a cm,则晶胞体积为a3cm3,碳原子直径为b cm,则晶胞中C原子总体积=4×$\frac{4}{3}$×π×( $\frac{1}{2}$b)3cm3=$\frac{2}{3}$πb3cm3,硅原子直径为c cm,则晶胞中Si原子总体积=4×$\frac{4}{3}$×π×( $\frac{1}{2}$c)3cm3=$\frac{2}{3}$πc3cm3,故晶胞中C、Si原子总体积=$\frac{2}{3}$πb3cm3+$\frac{2}{3}$πb3cm3=$\frac{2}{3}$π(b3+c3)cm3,故晶胞的空间利用率=$\frac{\frac{2}{3}π({b}^{3}+{c}^{3})}{{a}^{3}}$×100%=$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%,
故答案为:$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%.
点评 本题是对物质结构的考查,涉及核外电子排布规律、分子结构与性质、杂化轨道、晶胞计算、空间利用率的计算等,需要学生具有一定的空间想象与数学计算能力,难度中等.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
 碳酸钠是一种重要的化工产品,一种工业生产流程如图所示.
碳酸钠是一种重要的化工产品,一种工业生产流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
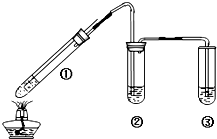 某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
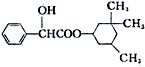 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )| A. | 该物质属于芳香烃 | |
| B. | 该有机物不能被氧化成醛 | |
| C. | 分子式为C17H23O3 | |
| D. | 1mol该物质最多可与2 mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com