
 2As+3 H2(2分)
2As+3 H2(2分) (2分)
(2分) (2分)
(2分)

科目:高中化学 来源:不详 题型:单选题
| A.原子的第一电离能越大,该元素的电负性就越大 |
| B.原子的电子层数越多,原子半径越大 |
| C.原子失去电子越多,说明其还原性越强 |
| D.同一原子的能层越高,S电子云的半径越大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2Se比H2O稳定 |
| B.最高价氧化物的水化物化学式为H2SeO4 |
| C.它有两种氧化物SeO2和SeO3 |
| D.其单质常温下呈固态 |
查看答案和解析>>
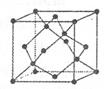
科目:高中化学 来源:不详 题型:单选题
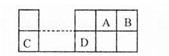
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
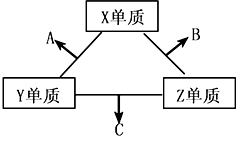
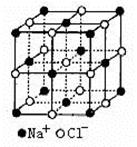
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com