
 2 NH3(g) ��H����92 kJ/mol
2 NH3(g) ��H����92 kJ/mol 4NO + 6H2O ��
4NO + 6H2O �� 2 NH3(g) ��H����92 kJ/mol����3����Ӧ�Ⱦ��Ƕ��ѻ�ѧ�����յ��������γɻ�ѧ���ͷŵ������IJ436 kJ/mol��3mol+946 kJ/mol��1mol-6X=��92 kJ/mol,���X=391 kJ/mol����4����ҵ�ϣ�����Ϊԭ����������ĵ�һ��Ϊ�����������÷�Ӧ�Ļ�ѧ����ʽ��4NH3 + 5O2
2 NH3(g) ��H����92 kJ/mol����3����Ӧ�Ⱦ��Ƕ��ѻ�ѧ�����յ��������γɻ�ѧ���ͷŵ������IJ436 kJ/mol��3mol+946 kJ/mol��1mol-6X=��92 kJ/mol,���X=391 kJ/mol����4����ҵ�ϣ�����Ϊԭ����������ĵ�һ��Ϊ�����������÷�Ӧ�Ļ�ѧ����ʽ��4NH3 + 5O2  4NO + 6H2O��
4NO + 6H2O��

 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��ѧ�� | C��H | C=C | C��C | H��H |
| ����/kJ��mol��1 | 414��4 | 615��3 | 347��4 | 435��3 |
 2NH3(g) ��H=��92��4kJ/mol
2NH3(g) ��H=��92��4kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��H2O (g)= H2(g)+ O2(g); ��H=" -485" kJ/mol O2(g); ��H=" -485" kJ/mol |
B��H2O (g)=H2(g)+ O2(g); ��H="=+485" kJ/mol O2(g); ��H="=+485" kJ/mol |
| C��2H2(g)+ O2 (g)= 2H2O(g) ��H =" +485" kJ/mol |
| D��2H2(g)+ O 2(g)=2H2O(g) ��H =" -485" kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ƶ���


 2HCl��g��+O2��g����H>0��
2HCl��g��+O2��g����H>0�� O2��g��= H2O��1��, ��H2 = -285��84kJ��mol-l
O2��g��= H2O��1��, ��H2 = -285��84kJ��mol-l�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ����һ | CO(g) +2H2(g)  CH3OH(g) CH3OH(g) |
| ������ | CO2(g) +3H2(g)  CH3OH(g) +H2O(g) CH3OH(g) +H2O(g) |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
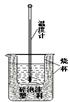
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
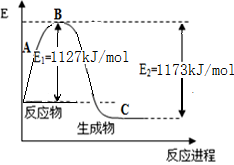
| A��Q1 + Q2 > Q3 | B��Q1 + Q2 > 2Q3 | C��Q1 + Q2 < Q3 | D��Q1+ Q2 < 2Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����ʯ�Һ�ˮ�ķ�Ӧ |
| B��ʯ��ʯ�ڸ����µķֽⷴӦ |
| C������������������Һ�ķ�Ӧ |
| D��ľ̿��������ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���Ͽ���ѧ���Ĺ��̻�ų����� |
| B�����ȷ�Ӧ�У���Ӧ�������������������������� |
| C�����Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ |
| D��������Ӧ��Ϊ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com