
| A. | 用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL | |
| B. | 用托盘天平称得25.20g NaCl | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用10mL量筒量取7.13mL稀盐酸 |
分析 A.滴定管可以准确度0.01mL;
B.托盘天平的准确度是0.1g;
C.pH试纸测定的溶液的酸碱性都是整数;
D.量筒的准确度为0.1mL.
解答 解:A.滴定管可以准确度0.01mL,可以读到21.70mL,故A正确;
B.托盘天平的准确度是0.1g,无法用托盘天平称量25.20g NaCl,故B错误;
C.pH试纸测定的溶液的酸碱性都是整数,不会出现小数,故C错误;
D.量筒的准确度为0.1mL,无法用10mL量筒量取7.13mL稀盐酸,故D错误;
故选A.
点评 本题考查化学实验方案的评价,涉及实验室常用仪器的准确度及pH试纸的特点,需要熟练掌握仪器的最小读数,本题难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | Na+,SO42-,Ca2+,Cl- | B. | ClO-,Ba2+,K+,NO3- | ||
| C. | HCO3-,Cl-,Na+,Ca2+ | D. | Fe2+,I-,Na+,K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | A | B | C | D | E | F |
| 烧瓶和气体的总质量(g) | 48.4082 | 48.4082 | 48.4082 | 48.3822 | 48.4342 | 48.8762 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非标准状况下,1mol任何气体的体积不可能为22.4L | |
| B. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| C. | 25℃,1.01×105Pa,16gCH4中含有的原子数为5NA | |
| D. | 92g NO2和N2O4的混合物含有的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 相同温度下,将足量氯化银固体分别加入:①蒸馏水、②0.1 mol•L-1氯化镁溶液、③0.1 mol•L-1盐酸、④0.1 mol•L-1硝酸银溶液中,充分溶解后Ag+浓度:①>③=④>② | |
| C. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7 | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
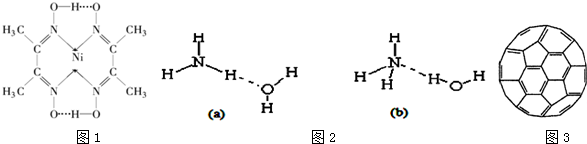
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com