
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:选择题
25℃、101kPa下,4g CH4完全燃烧生成CO2和液态水时,放出222.5 kJ的热量,则下列热化学方程式中正确的是( )
A.CH4(g)+2O2(g)=CO2(g)+2 H2O(g ) △H=-890kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2 H2O(l ) △H=+890kJ/mol
C.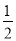 CH4(g)+O2(g)=
CH4(g)+O2(g)= 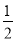 CO2(g)+H2O(1) △H=-445kJ/mol
CO2(g)+H2O(1) △H=-445kJ/mol
D.CH4(g)+2O2(g)=CO2(g)+2 H2O(l ) △H=-890kJ
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期中(文)化学试卷(解析版) 题型:填空题
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明
请根据此表,回答下列问题。
配料表 | 精制海盐、碘酸钾 |
含碘量 | 20~40m/kg |
卫生许可证号 | X X 卫碘字(1999)第001号 |
分装日期 | 见封底 |
储藏方法 | 密封、避光、防潮 |
食用方法 | 烹调时.待食品熟后加人碘盐 |
(1)要在食盐中加碘.是因为碘是人体内合成________激素的主要原料,缺碘会引起疾病。这里的“碘”指的是_________ (填“元素”或“单质”);
(2)碘酸钾的化学式为Kl03其中碘元素的化合价为______,根据含碘盐的食用方法可推测,碘酸钾在受热时容易_______;
(3)食物中的_________等海产品中含碘较多。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高一上半期测试化学试卷(解析版) 题型:选择题
下列变化,需要加入适当的氧化剂才能完成的是
A.CuO → Cu B.Fe → FeCl2 C.H2SO4 → Na2SO4 D.HNO3 → NO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省高二上12月段考化学试卷(解析版) 题型:选择题
我国城市环境中的大气污染物主要是
A.CO2、Cl2、N2、酸雨 B.SO2、NO2、CO、可吸入颗粒物
C.NH3、CO2、NO2、雾 D.HCl、SO2、N2、可吸入颗粒物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第三次月考化学试卷(解析版) 题型:选择题
下列离子在指定溶液中一定能大量共存的是
A.加入Al能放出H2的溶液中:Fe2+、Al3+、NO3?、Cl?
B.pH=13的溶液中:Na+、CO、K+、HCO3?
C.在无色溶液中:Cu2+、Ca2+、SO、Cl?
D.加入Mg能放出H2的溶液中:Mg2+、Cl?、K+、SO
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高一上第二次月考化学试卷(解析版) 题型:填空题
在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出x=________;y=________。
(2)配平该反应的方程式:
____FeSO4+___KNO3+____H2SO4 = ____K2SO4+____Fe2(SO4)3+____ (NxOy)+____H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+____H2O(配平时x、y用具体数值表示,物质填在 中)。
中)。
(3)反应中氧化产物是__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在101kPa下氢气的燃烧热△H= -285.5kJ•mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1
B.pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
C.一定温度下,1L0.50mol/LNH4Cl溶液与2L0.25NH4Cl溶液含NH4+物质的是不同
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省分校高三上期中测试理综化学试卷(解析版) 题型:填空题
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的化学反应方程式_____________________________
(2)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O=Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目___________________________
(4)实验中,准确称量SeO2样品0.150 0 g,消耗0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com