
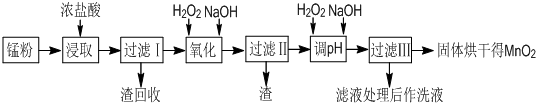
£Ø16·Ö£©»ŲŹÕµÄ·Ļ¾ÉŠæĆĢøɵē³Ų¾¹ż“¦ĄķŗóæɵƵ½ĆĢ·Ū£ØÖ÷ŅŖŗ¬MnO2”¢Mn(OH)2”¢Fe”¢NH4ClŗĶĢæŗŚµČ£©£¬ÓÉĆĢ·ŪÖĘČ”MnO2µÄ²½ÖčŗĶŹż¾ŻČēĻĀ£ŗ
| ĪļÖŹ | æŖŹ¼³Įµķ | ³ĮµķĶźČ« |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
£Ø1£©ŌŚ¼ÓČČĢõ¼žĻĀ£¬ÓĆÅØŃĪĖį½žČ”ĆĢ·ŪµĆµ½ŗ¬ÓŠMn2+”¢Fe3+µČĄė×ÓµÄČÜŅŗ£¬MnO2ÓėÅØŃĪĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½ £¬øĆ“¦Ąķ·½·ØµÄȱµć ”£
£Ø2£©²½ÖčIÖŠĀĖŌüµÄ»ÆѧŹ½ £¬²½ÖčIÖŠĀĖŌüµÄ»ÆѧŹ½ ”£
£Ø3£©Ļņ²½ÖčIµÄĀĖŅŗÖŠ¼Ó×ćĮæH2O2µÄ×÷ÓĆĪŖ ”£ŌŁ¼ÓNaOHČÜŅŗµ÷½ŚpHŌŚ3.7<pH<8.3£¬ÄæµÄŹĒ ”£
£Ø4£©Ļņ²½ÖčIIµÄĀĖŅŗÖŠH2O2ČÜŅŗ£¬ŌŁ¼ÓNaOHČÜŅŗµ÷½ŚpHĪŖ9£¬Ź¹Mn2+×Ŗ»Æ³ÉMnO2£¬ŌŚÕāŅ»¹ż³ĢÖŠH2O2Ęš £ØĢīŃõ»Æ¼Į”¢»¹Ō¼Į£©µÄ×÷ÓĆ”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ¹ć¶«Ź”»ŻÖŻŹŠ2011½ģøßČżµŚŅ»“Īµ÷ŃŠæ¼ŹŌ£ØĄķ×Ū£©»Æѧ²æ·Ö ĢāŠĶ£ŗĢīæÕĢā
£Ø16·Ö£©»ŲŹÕµÄ·Ļ¾ÉŠæĆĢøɵē³Ų¾¹ż“¦ĄķŗóæɵƵ½ĆĢ·Ū£ØÖ÷ŅŖŗ¬MnO2”¢Mn(OH)2”¢Fe”¢NH4ClŗĶĢæŗŚµČ£©£¬ÓÉĆĢ·ŪÖĘČ”MnO2µÄ²½ÖčŗĶŹż¾ŻČēĻĀ£ŗ
| ĪļÖŹ | æŖŹ¼³Įµķ | ³ĮµķĶźČ« |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğ¹ć¶«Ź”ÉĒĶ·ŹŠøßČż3ŌĀøßæ¼Ä£ÄāĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
»ŲŹÕµÄ·Ļ¾ÉŠæĆĢøɵē³Ų¾¹ż“¦ĄķŗóµĆµ½ĆĢ·Ū(ŗ¬MnO2”¢Mn(OH)2”¢Fe”¢ŅŅČ²ŗĶŗŚĢæµČ)£¬ÓÉĆĢ·ŪÖĘČ”MnO2µÄ²½ÖčČēĻĀĶ¼ĖłŹ¾”£
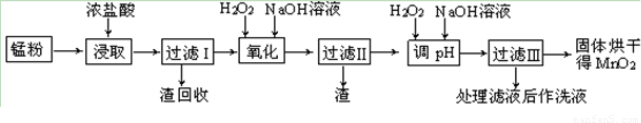
øł¾ŻÉĻĶ¼ĖłŹ¾²½Öč²¢²Īæ¼±ķøńŹż¾Ż£¬»Ų“šĻĀĮŠĪŹĢā”£
Īļ ÖŹ | æŖŹ¼³Įµķ | ³ĮµķĶźČ« |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
£Ø1£©ŌŚ¼ÓČČĢõ¼žĻĀÓĆÅØŃĪĖį½žČ”ĆĢ·Ū£¬ĖłµĆČÜŅŗÖŠŗ¬ÓŠMn2+”¢Fe2+µČ”£MnO2ÓėÅØŃĪĖį·“Ó¦µÄĄė×Ó·½³Ģ·½³ĢŹ½£ŗ?????????????????????????????????????????????????????? _”£
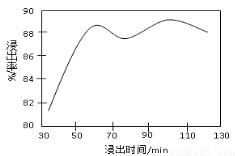
£Ø2£©Ėį½žŹ±£¬½ž³öŹ±¼ä¶ŌĆĢ½ž³öĀŹµÄÓ°ĻģČēĻĀĶ¼ĖłŹ¾£¬¹¤Ņµ²ÉÓƵďĒ½žČ”60 min£¬ĘäæÉÄÜŌŅņŹĒ???????????????????????????????????????????????????? ”£
£Ø3£©ĆĢ·Ū¾ÅØŃĪĖį½žČ”£¬¹żĀĖI³żČ„²»ČÜŌÓÖŹŗó£¬ĻņĀĖŅŗÖŠ¼ÓČė×ćĮæH2O2ČÜŅŗ£¬Ęä×÷ÓĆŹĒ????????????????????????????????? ”£
£Ø4£©¹żĀĖIĖłµĆĀĖŅŗ¾Ńõ»Æŗ󣬊č¼ÓČėNaOHČÜŅŗµ÷½ŚpHŌ¼ĪŖ5.1£¬ĘäÄæµÄŹĒ?????????????????????????????????????????????? ”£
£Ø5£©¹żĀĖ¢ņĖłµĆĀĖŅŗ¼ÓČė×ćĮæH2O2ČÜŅŗ²¢¼ÓČėNaOHČÜŅŗµ÷½ŚpHŌ¼ĪŖ9£¬Ź¹Mn2+ Ńõ»ÆµĆµ½MnO2£¬·“Ó¦µÄĄėÓŚ·½³ĢŹ½ĪŖ????????????????????????????????????????????????????? ”£
£Ø6£©¹¤ŅµÉĻĄūÓĆKOHŗĶMnO2ĪŖŌĮĻÖĘČ”KMnO4”£Ö÷ŅŖÉś²ś¹ż³Ģ·ÖĮ½²½½ųŠŠ£ŗµŚŅ»²½½«MnO2ŗĶ¹ĢĢåKOH·ŪĖ飬»ģŗĻ¾łŌČ£¬ŌŚæÕĘųÖŠ¼ÓČČÖĮČŪ»Æ£¬²¢Į¬Šų½Į°čŅŌÖĘČ”K2MnO4£»µŚ¶ž²½ĪŖµē½āK2MnO4µÄÅØČÜŅŗÖĘČ”KMnO4”£
¢Ł µŚŅ»²½·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ???????????????????????????????????????????????????????????? ”£
¢Ś µē½āK2MnO4µÄÅØČÜŅŗŹ±£¬µē½ā³ŲÖŠŅõ¼«µÄŹµŃéĻÖĻóĪŖ???????????????????????????????????????? ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ¹ć¶«Ź”»ŻÖŻŹŠ2010-2011ѧğøßČżµŚŅ»“Īµ÷ŃŠæ¼ŹŌ£ØĄķ×Ū£©»Æѧ²æ·Ö ĢāŠĶ£ŗĢīæÕĢā
£Ø16·Ö£©»ŲŹÕµÄ·Ļ¾ÉŠæĆĢøɵē³Ų¾¹ż“¦ĄķŗóæɵƵ½ĆĢ·Ū£ØÖ÷ŅŖŗ¬MnO2”¢Mn(OH)2”¢Fe”¢NH4ClŗĶĢæŗŚµČ£©£¬ÓÉĆĢ·ŪÖĘČ”MnO2µÄ²½ÖčŗĶŹż¾ŻČēĻĀ£ŗ

|
ĪļÖŹ |
æŖŹ¼³Įµķ |
³ĮµķĶźČ« |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Fe(OH)2 |
8.3 |
9.8 |
£Ø1£©ŌŚ¼ÓČČĢõ¼žĻĀ£¬ÓĆÅØŃĪĖį½žČ”ĆĢ·ŪµĆµ½ŗ¬ÓŠMn2+”¢Fe3+µČĄė×ÓµÄČÜŅŗ£¬MnO2ÓėÅØŃĪĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½ £¬øĆ“¦Ąķ·½·ØµÄȱµć ”£
£Ø2£©²½ÖčIÖŠĀĖŌüµÄ»ÆѧŹ½ £¬²½ÖčIÖŠĀĖŌüµÄ»ÆѧŹ½ ”£
£Ø3£©Ļņ²½ÖčIµÄĀĖŅŗÖŠ¼Ó×ćĮæH2O2µÄ×÷ÓĆĪŖ ”£ŌŁ¼ÓNaOHČÜŅŗµ÷½ŚpHŌŚ3.7<pH<8.3£¬ÄæµÄŹĒ ”£
£Ø4£©Ļņ²½ÖčIIµÄĀĖŅŗÖŠH2O2ČÜŅŗ£¬ŌŁ¼ÓNaOHČÜŅŗµ÷½ŚpHĪŖ9£¬Ź¹Mn2+×Ŗ»Æ³ÉMnO2£¬ŌŚÕāŅ»¹ż³ĢÖŠH2O2Ęš £ØĢīŃõ»Æ¼Į”¢»¹Ō¼Į£©µÄ×÷ÓĆ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com