
| A. | 金属钠、碳化钙着火时,可直接用高压水枪喷火扑灭 | |
| B. | 去除银器表面的Ag2S,可将银器放在盛有食醋的铝锅中煮沸 | |
| C. | 苹果在空气中久置变黄和纸张变黄的原理相似 | |
| D. | 用乙醚从黄花蒿中萃取青蒿素发生了氧化还原反应 |
分析 A.钠、电石能与水反应分别生成氢气、乙炔;
B.Ag2S和Al在醋酸溶液中发生反应生成银、醋酸铝和硫化氢;
C.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子;
D.氧化还原反应的特征是元素化合价的升降;
解答 解:A.钠、电石能与水反应分别生成氢气、乙炔,二者都是易燃烧的物质,所以不能用高压水枪喷水灭火,故A错误;
B.Ag2S和Al在醋酸溶液中发生反应生成银、醋酸铝和硫化氢,故B正确;
C.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子,二者原理不相同,故C错误;
D.用乙醚从黄花蒿中提取青蒿素,利用了物质的溶解性,属于物理性质,故D错误;
故选:B.
点评 本题考查了元素化合物知识,涉及钠、电石、二价铁离子性质,氧化还原反应判断依据,明确相关物质的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
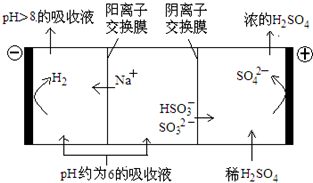
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当A一定时,K值越小,则元素的非金属性越强 | |
| B. | 当K=0,则该元素系同一周期中最活泼的金属元素 | |
| C. | 当n一定时,随着K值增大,则元素的非金属性逐渐增强 | |
| D. | 当K=l时,则该元素系过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实 | 原理 |
| A | 用漂白精溶液对环境消毒 | 病毒蛋白质在漂白精溶液中发生盐析现象 |
| B | 用碳酸钠溶液浸泡水垢 | 水垢中溶解度较大的物质转化为溶解度较小的物质 |
| C | 含碘的食盐密闭保存于阴凉处 | 碘化钾不稳定易分解,从而损失碘元素 |
| D | 用纯碱溶液洗涤餐具表面油污 | 碳酸钠与油脂发生复分解反应生成可溶物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 变化的化学方程式是:NaCl03+KCl=KClO3(结晶)+NaCl | |
| B. | KClO3是难溶物 | |
| C. | KClO3是比NaClO3更弱的电解质 | |
| D. | 相同温度下,KCl03的溶解度比NaCl03小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
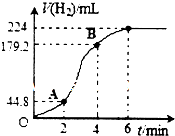 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4) /mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 20 | 2滴CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属的密度随着原子序数的递增逐渐减小 | |
| B. | 钾与氧气或水反应比钠与氧气或水反应剧烈,铷、铯的相应反应更剧烈 | |
| C. | 随着原子序数的递增碱金属单质的熔沸点升高 | |
| D. | 碱金属元素阳离子的氧化性随着原子序数的递增依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
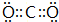 ,
,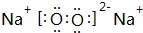
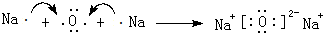 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com