



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
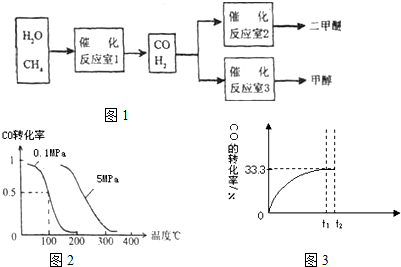
 ��2012?��������ģ���о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ���⣮CO�����ںϳɼ״�����ѹǿΪ0.1MPa�����£������Ϊb L���ܱ������г���a mol CO��2a mol H2���ڴ��������ºϳɼ״���CO��g��+2H2��g��?CH3OH��g����ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
��2012?��������ģ���о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ���⣮CO�����ںϳɼ״�����ѹǿΪ0.1MPa�����£������Ϊb L���ܱ������г���a mol CO��2a mol H2���ڴ��������ºϳɼ״���CO��g��+2H2��g��?CH3OH��g����ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| V2 |
| a2 |
| V2 |
| a2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��10�֣����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣��֪��
SO2��g�� ��1/2O2��g�� SO3��g�� ��H����98kJ��mol��1��
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��10/3�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 mol O2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С��
�� ������ĸ����
A�������¶Ⱥ�����������䣬����1.0 mol O2
B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3
C�������¶�
D���ƶ�����ѹ������
��4��������ͼ��ʾװ�ã��õ绯ѧԭ���������ᣬд��ͨ��O2�缫�ĵ缫��ӦʽΪ ��
Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ____________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�긣��ʡ��������У�����ڶ������Ͽ��Ի�ѧ�Ծ� ���ͣ������
��10�֣����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣��֪��
SO2��g�� ��1/2O2��g�� SO3��g�� ��H����98
kJ��mol��1��
SO3��g�� ��H����98
kJ��mol��1��
��1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��10/3�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱv������ v���棩�����������������������
��2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 mol O2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ ��
��3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С��
�� ������ĸ����
A�������¶Ⱥ�����������䣬����1.0 mol O2
B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3
C�������¶�
D���ƶ�����ѹ������
��4��������ͼ��ʾװ�ã��õ绯ѧԭ���������ᣬд��ͨ��O2�缫�ĵ缫��ӦʽΪ ��
Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ____________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꽭��ʡ�߶���ѧ����ĩ���Ի�ѧ ���ͣ�������
��10�֣����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣��֪�� ��SO2��g�� ��1/2O2��g��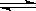 SO3��g�� ��H����98 kJ��mol��1��
SO3��g�� ��H����98 kJ��mol��1��
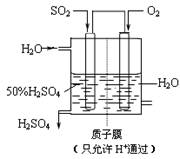
(1��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K��10/3�����ڴ��¶��£���100 L�ĺ����ܱ������У�����3.0 mol SO2(g)��16.0 mol O2(g)��3.0 mol SO3(g)����Ӧ��ʼʱ
v������ v���棩�����������������������
(2��һ���¶��£���һ�����������Ϊ2 L���ܱ������г���2.0 mol SO2��1.0 mol O2���ﵽƽ��������Ϊ1.6 L����SO2��ƽ��ת����Ϊ ��
(3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2(g)ƽ��Ũ�ȱ�ԭ����С���� (����ĸ����
A�������¶Ⱥ�����������䣬����1.0 mol O2
B�������¶Ⱥ�������ѹǿ���䣬����1.0 mol SO3
C�������¶�
D���ƶ�����ѹ������
(4��������ͼ��ʾװ�ã��õ绯ѧԭ���������ᣬд��ͨ��O2�缫�ĵ缫��ӦʽΪ ��
(5��Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ
_______ _____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com