
| 元素 | A | B | C | D | |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同. | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强 |
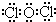 ,次氯酸是弱酸,在光照条件下,次氯酸分解生成盐酸和氧气,所以溶液酸性增强,发生2HClO
,次氯酸是弱酸,在光照条件下,次氯酸分解生成盐酸和氧气,所以溶液酸性增强,发生2HClO
| ||
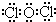 ;2HClO
;2HClO
| ||
| 20.04mL+19.96mL+20.00mL |
| 3 |
| 1000ml |
| 25ml |
| 0.125Kg |
| 1Kg |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的浓度对氢气生成速率的影响,该小组同学开始了实验探究.
某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的浓度对氢气生成速率的影响,该小组同学开始了实验探究.| 混合溶液组成 | A组 | B组 | C组 | D组 | E组 | F组 |
| 4mol/LH2SO4 | 30mL | V1 mL | V2 mL | V3 mL | V4 mL | V5 mL |
| 饱和CuSO4溶液 | 0mL | 0.5mL | 2.5mL | 5mL | V6 mL | 20mL |
| H2O | V7 mL | V8 mL | V9 mL | V10 mL | 10mL | 0mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②③ | C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Al能放出H2的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| B、能使酚酞变红的溶液中:K+、Na+、Cl-、CO32- |
| C、无色透明的水溶液中:K+、Ba2+、I-、MnO4- |
| D、常温下,在c(H+)/c(OH-)=1×10-12的溶液中:Fe2+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.3000C时的恒容密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答下列问题:
已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.3000C时的恒容密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某待测液加入AgNO3溶液,生成白色沉淀,说明原溶液中有Cl- |
| B、某待测液加入BaCl2溶液,生成白色沉淀,说明原溶液中有SO42- |
| C、某待测液加入CaCl2溶液,生成白色沉淀,说明原溶液中有CO32- |
| D、某待测液加入NaOH溶液,生成蓝色沉淀,说明原溶液中有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应是熵减小反应 |
| B、该反应是吸热反应 |
| C、该反应需要和高的温度 |
| D、该反应是熵减小,烙增加的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com