
分析 (1)根据配制500mL、0.2mol•L-1的稀H2SO4的步骤选择使用的仪器,然后判断不需要的仪器;
(2)根据c=×$\frac{1000ρw}{M}$计算出浓硫酸的物质的量浓度,然后根据溶液稀释过程中溶质的物质的量不变计算出浓硫酸的体积;
(3)根据溶液配制,一般可分为以下步骤:计算、称量、溶解或稀释、冷却、转移、洗涤、定容、摇匀据此进行排序;
(4)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(5)稀释前后氢离子物质的量保持不变.
解答 解:(1)配制500mL、0.2mol•L-1的稀H2SO4的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要选用的仪器为:量筒、烧杯、玻璃棒、容量瓶、胶头滴管、500mL容量瓶等,不需要的仪器为:②烧瓶、④药匙、⑦托盘天平,还欠缺的仪器是胶头滴管,
故答案为:②④⑦;胶头滴管;
(2)该浓硫酸的物质的量浓度为:$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制500mL、0.2mol•L-1的稀H2SO4,需要浓硫酸的体积为:$\frac{0.2mol/L×0.5L}{18.4mol/L}$≈0.0054L=5.4mL,
故答案为:5.4mL;
(3)稀硫酸配制,一般可分为以下步骤:计算、称量、稀释、冷却、转移、洗涤、定容、摇匀,所以其操作顺序是BEACADF,
故答案为:BEACADF;
(4)①量取浓硫酸的量筒不能洗涤,如果洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,会导致量取的浓硫酸体积偏大,配制的溶液浓度偏高;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,热的溶液体积判断,冷却后溶液体积变小,配制的溶液浓度偏高;
③定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致配制的溶液体积偏大,配制的溶液浓度偏低;
④转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量及溶液体积没有影响,不影响配制结果;
⑤定容时,俯视标线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,
故答案为:①②⑤;
(5)0.2mol/L×0.025L×2=c(H+)×0.1L,解得c(H+)=0.1mol/L,
故答案为:0.1mol/L.
点评 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
下列有关胶体的说法中,不正确的是
A.胶体、溶液、浊液的分类依据是分散质微粒直径大小
B.“卤水点豆腐”、“黄河入海口处的沙洲”都与胶体的聚沉有关
C.向 1 mol•L﹣1 氯化铁溶液中加入少量的 NaOH 溶液 制取氢氧化铁胶体
制取氢氧化铁胶体
D.可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | HCl | C. | CaCO3(固体) | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.40 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
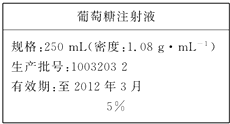 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{x}^{y}$R | B. | ${\;}_{z}^{y+x}$R | C. | ${\;}_{x+z}^{y}$R | D. | ${\;}_{x+z}^{y+x+z}$R |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com