
【题目】某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如下图所示的装置。请回答下列问题。

(1)铜和浓硫酸反应中浓硫酸的作用为______________。
(2)B 瓶中盛有品红溶液,观察到品红溶液褪色,这是因为SO2具有_______,C 瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有_________。
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有足量NaOH溶液以除去SO2,该反应的主要产物的化学式为________。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入____________
A .HNO3 B .NaNO3 C.NaHCO3 D.Na2CO3
【答案】(1)强氧化剂、酸性 ;(2)C、B;(3)Na2SO3;(4)AB
【解析】
试题分析:(1)铜和热的浓硫酸反应生成硫酸铜、二氧化硫和水,所以铜和浓硫酸反应中浓硫酸的作用为强氧化剂和酸性。
(2)二氧化硫与品红溶液反应生成不稳定的无色物质,二氧化硫与品红作用,二氧化硫具有漂白性;二氧化硫具有还原性,能被氯水氧化导致氯水褪色,答案选C;B
(3)SO2是酸性氧化物,也是大气污染物,所以用NaOH溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,反应的方程式为2NaOH+SO2=Na2SO3+H2O,所以该反应的主要产物的化学式为Na2SO3。
(4)铜和浓硫酸反应时,当硫酸浓度减小到一定程度时,该反应停止,可以加入氧化剂硝酸,铜能继续溶解;还可以加入NaNO3,NaNO3与稀硫酸在同一溶液相当于稀硝酸,稀硝酸能和铜单质在常温下反应,答案选AB。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.使用填埋法处理未经分类的生活垃圾
B.用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用
C.大量使用薪柴为燃料,践行低碳生活
D.CO2、NO2或SO2的排放是形成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组欲通过实验方法验证Fe2+的某些性质。
(1)在实验前,依据Fe2+的 性,填写了下表。
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+ =Fe3++NO2↑+H2O |
依照表中操作,该同学进行实验。观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色。
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为红色,则溶液中含有 ;另一只试管滴加几滴 溶液,产生蓝色沉淀,则含有Fe2+。
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的。
提出猜想:
i.NO2与Fe2+发生反应 ⅱ.NO2与Fe3+发生反应
ⅲ.NO与Fe2+发生反应 ⅳ.
(4)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究。

步骤 | 操作及现象 | 解释或结论 |
① | 关闭k、b,打开a,开始甲中反应一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。 | 溶液深棕色由 与NO或NO2反应而得到。 |
② | 停止甲中反应,打开活塞k、b、关闭a,持续通入N2一段时间。 | 该操作的目的是 |
③ | 更换新的丙、丁装置,再这一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同。 | 乙瓶中发生的化学方程式为 。 |
(5)结合实验猜想,得出结论:
溶液呈深棕色的原因,肯定成立的是猜想 ;不确定的是猜想 ,有待后续实验进一步探究。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.糖类是有甜味的物质
B.糖类组成一定符合通式Cm(H2O)n
C.糖类是人类维持生命的六大类营养素之一
D.符合通式Cm(H2O)n的一定是糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。下图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)上述反应中_________是氧化剂,_________是还原剂,若反应中氧化产物比还原产物多1mol,则转移的电子数目为__________。
(2)装置B的作用是_____________,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_________________。
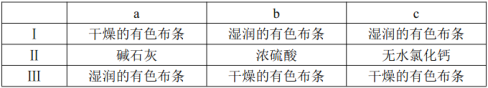
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入________(选“a”“b”或“c”)。
(4)设计装置D、E的目的是为了比较Cl2、Br2、I2的氧化性强弱。已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶苯,且I2的苯溶液为紫红色。当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用双线桥法表示出电子转移情况:________________。打开活塞,将D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色。该现象___________(填“能”或“不能”)说明Br2的氧化性大于I2。
(5)装置F的作用是除去污染性的物质(Cl2、Br2等),已知Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且c(Cl-)/c(ClO-)的值与温度高低有关。若烧杯中装有500mL0.2mol/L的NaOH溶液,则最多可吸收标况下的Cl2的体积为____________L(忽略Cl2溶于水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素及化合物的叙述,正确的是
A. 所有细胞中水占鲜重百分比都一样
B. O是构成细胞的大量元素之—,在人体细胞的干重中含量最多
C. 水是占细胞鲜重百分比最大的化合物
D. 构成细胞的任何一种化合物都能在无机自然界找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与资源、环境、生活关系密切,下列说法正确的是 ( )
A.空气中PM2.5(2.5微米以下的颗粒物)的存在能够形成丁达尔效应
B.煤燃烧时加入少量的生石灰可以减少废气中的二氧化硫排放
C.将造纸废水通过高压水井压到地下,节约生产成本
D.绿色化学的核心是应用化学原理对环境污染进行治理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com