
| A.反应2Mg+CO22MgO+C ΔH<0从熵变角度看,可以自发进行 |
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
科目:高中化学 来源:不详 题型:单选题
 2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是| | 改变条件 | 新平衡与原平衡比较 |
| A | 增大压强 | N2的浓度一定变小 |
| B | 升高温度 | N2的转化率变小 |
| C | 充入一定量H2 | H2的转化率不变,N2的转化率变大 |
| D | 使用适当催化剂 | NH3的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )
?2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )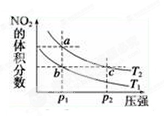
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深,c浅 |
| C.b、c两点的平衡常数:b<c |
| D.a、c两点气体的平均相对分子质量:a>c |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
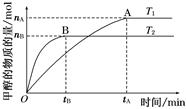
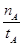 mol·L-1·min-1
mol·L-1·min-1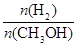 增大
增大查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )| A.4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ |
B.平衡时v正(O2)=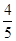 v逆(NO) v逆(NO) |
| C.平衡后降低压强,混合气体平均摩尔质量增大 |
| D.平衡后升高温度,混合气体中NO含量降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。
3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。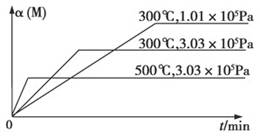
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | X | Y | Z |
| 初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
 2Z(g),其平衡常数为1 600
2Z(g),其平衡常数为1 600查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com