
【题目】将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B2C,在反应过程中C的物质的量分数随温度变化如图所示: 
(1)T0对应的反应速率v(正)v(逆)(用“=”、“>”或“<”表示,下同);
(2)此反应的正反应为热;(填“放”或“吸”)
(3)X、Y两点A物质正反应速率的大小关系是YX;
(4)温度T<T0时,C%逐渐增大的原因是:;
(5)若Y点的C的物质的量分数为25%,则参加反应的A物质的量为mol.
【答案】
(1)=
(2)放
(3)>
(4)反应未达平衡,仍在向正反应方向移动
(5)1.8
【解析】解:(1)起始时加入物质的量均为3.00mol的物质A、B,随着温度的升高,反应向正反应方向进行,当温度达到T0时,C的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等,故答案为:=;(2)随着温度的继续升高,C的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,故答案为:放;(3)温度越高,反应速率越大,Y点温度大于X点,则X点反应速率小于Y点,故答案为:Y>X;(4)温度T0前,反应还没有到达平衡,反应向正反应进行,随着温度升高,生成的C越来越多,
故答案为:反应还没有到达平衡,反应向正反应进行;(5)设参加反应的A的物质的量为x,根据方程式知:平衡状态时A的物质的量=(3﹣x)mol,B的物质的量=(3﹣ ![]() )mol,C的物质的量=
)mol,C的物质的量= ![]() xmol,C的物质的量分数=
xmol,C的物质的量分数=  ×100%=25%,x=1.8mol,
×100%=25%,x=1.8mol,
故答案为:1.8.
(1)起始时加入物质的量均为3.00mol的物质A、B,随着温度的升高,反应向正反应方向进行,当温度达到T0时,C的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等;(2)随着温度的继续升高,C的物质的量分数逐渐减小,说明温度升高平衡左移;(3)温度越高,反应速率越大;(4)反应还没有到达平衡,反应正向进行,随着温度升高,生成的C越来越多;(5)设参加反应的A的物质的量为x,根据方程式知:平衡状态时A的物质的量=(3﹣x)mol,B的物质的量=(3﹣ ![]() )mol,C的物质的量=
)mol,C的物质的量= ![]() xmol,C的物质的量分数=
xmol,C的物质的量分数=  ×100%=25%,从而计算参加反应的A的物质的量.
×100%=25%,从而计算参加反应的A的物质的量.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知两种有机色素A与B混合在一起,经测定知A的极性比B强,则下列说法正确的是()
A.用溶解过滤法,B不溶A溶于水
B.用重结晶法,A在水中的溶解度比B大
C.用蒸馏法,因为A的熔沸点高
D.用纸层析法,丙酮为展开剂,下端为A,上端为B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.国庆70周年大典放飞的气球由可降解材料制成,主要成分是聚乙烯
B.歼- 20上用到的氮化镓材料是一种金属合金材料
C.我国发射的“嫦娥三号”卫星所使用的碳纤维,是一种无机非金属材料
D.“绿水青山就是金山银山”。推广聚氯乙烯代替木材,生产快餐盒等,以减少术材的使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电离平衡常数:H2CO3>HClO>HCO ![]() .下列离子反应方程式正确的是( ) ①NaClO溶液中通入少量二氧化碳:2ClO﹣+CO2+H2O═2HClO+CO
.下列离子反应方程式正确的是( ) ①NaClO溶液中通入少量二氧化碳:2ClO﹣+CO2+H2O═2HClO+CO ![]()
②Na2CO3溶液中加入HClO溶液:CO ![]() +HClO═HCO
+HClO═HCO ![]() +ClO﹣
+ClO﹣
③等物质的量的Cl2与Na2CO3溶液恰好反应:Cl2+CO ![]() +H2O═HCO
+H2O═HCO ![]() +Cl﹣+HClO
+Cl﹣+HClO
④Cl2通入NaHCO3溶液中:Cl2+2HCO ![]() ═2CO2↑+Cl﹣+ClO﹣+H2O.
═2CO2↑+Cl﹣+ClO﹣+H2O.
A.②④
B.①③
C.②③
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图: 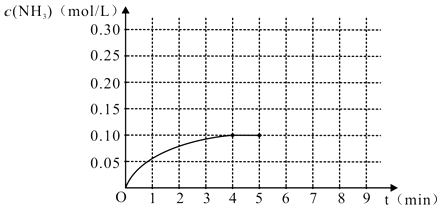
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为 .
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 .
A.0.20mol/L
B.0.12mol/L
C.0.10mol/L
D.0.08mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂元素被誉为“能源元素”.锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用.
(1)Ⅰ锂的原子结构示意图为;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式 .
(2)Ⅱ下面是从锂辉石(Li2OAl2O3SiO2)中提出锂的工业流程示意图.
①高温煅烧时的反应原理为:
Li2OAl2O3SiO2+K2SO4═K2OAl2O3SiO2+Li2SO4
Li2OAl2O3SiO2+Na2SO4═Na2OAl2O3SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ .
③几种金属离子沉淀完全的pH
金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g/100g水)
温度 | 10℃ | 20℃ | 50℃ | 80℃ |
Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
a.浸取时使用冷水的原因是 .
b.滤渣2的主要成分为 .
c.流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是 , 用离子方程式表示其产生的原因 .
d.加热浓缩的作用是 .
e.洗涤Li2CO3晶体使用 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述正确的是( )
A.在反应中不一定所有元素的化合价都发生变化
B.肯定有一种元素被氧化,另一种元素被还原
C.非金属单质在反应中只作氧化剂
D.金属原子失电子越多,其还原性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是______,其离子的原子结构示意图为______________。
(2)元素的最高价氧化物对应的水化物中酸性最强的是____________,碱性最强的是____________,呈两性的氢氧化物是________________。
(3)按要求写出下列两种物质的电子式:①的氢化物__________________;⑨的最高价氧化物对应的水化物_______________________;
(4)在⑦与⑩的单质中,化学性质较活泼的是______,可用什么化学反应说明该事实(写出反应的化学方程式) :__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com