
| A. | 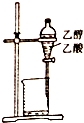 除去乙醇中的乙酸 | B. | 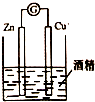 形成原电池 | ||
| C. | 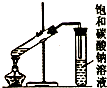 制取乙酸乙酯 | D. | 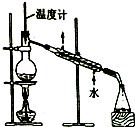 石油的蒸馏 |
分析 A.乙醇和乙酸互溶;
B.酒精是非电解质;
C.制取乙酸乙酯时用酒精灯外焰加热;
D.石油蒸馏时,温度计水银球位于烧瓶支管口处,且冷凝管中水流方向为下进上出.
解答 解:A.乙醇和乙酸互溶,所以不能采用分液方法分离,乙酸可以和氢氧化钠反应生成乙酸钠和水,将乙醇和乙酸钠的水溶液的可以采用蒸馏法分离,故A错误;
B.酒精是非电解质,该装置不能自发进行氧化还原反应,所以不能构成原电池,故B错误;
C.加热时应该应酒精灯外焰而不是焰心,故C错误;
D.石油蒸馏时,温度计水银球位于烧瓶支管口处,且冷凝管中水流方向为下进上出,所以符合实验操作规范,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质的分离和提纯、原电池原理、基本操作等知识点,从基本操作规范性及物质性质、原电池构成条件来解答即可,注意D中冷凝管内水流方向,为易错点.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的NaHSO3溶液中:c(OH-)-c(H+)=c(SO32-)-c(H2SO3) | |
| B. | 1L 0.1mol/L的(NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| D. | 向0.01mol/L的NH4HSO4溶液中滴加NaOH溶液至中性时:c(SO42-)>c(Na+)=c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,28g C2H4中含有的极性共价键数为6NA | |
| B. | 在氢氧化钡溶液中加入少量的硫酸氢钠溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 浓度均为0.1 mol•L-1的C6H5ONa溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者 | |
| D. | 常温下,浓度分别为0.1 mol•L-1和0.01 mol•L-1的CH3COOH溶液中:CH3COO-离子浓度前者是后者的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2的标准燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为: H2(g)+1/2O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ | |
| C. | NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)
已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加SO2的浓度 | B. | 充入一定量惰性气体 | ||
| C. | 升高温度 | D. | 使用催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com