
【题目】已知反应:CO(g)+H2O(g)CO2(g)+H2(g),△H<0,在850℃,K=1,
(1)若升高到950℃,达到平衡时K1(填“大于”、“小于”或“等于”)
(2)在850℃,若向一容积可变的密闭容器中同时充入1molCO、3molH2O、1molCO2和xmol的H2: ①当x=5时,上述平衡向(填“正反应”或“逆反应”)方向进行
②若要使上述反应开始时向正反应方向进行,则x的取值为
③当x=5mol和x=6mol,上述反应达到平衡后,H2的体积分数分别为a%和b%,则a%b%(填“大于”、“小于”或“等于”).
【答案】
(1)小于
(2)逆反应;0≤x<3;小于
【解析】解答:(1)该反应是一个放热反应,升高温度,平衡常数减小,所以K<1,所以答案是:小于;(2))①此时的浓度商Qc= ![]() =1.67,大于平衡常数1,故平衡向逆反应方向移动,所以答案是:逆反应;②平衡向正反应方向移动,浓度商小于平衡常数,即
=1.67,大于平衡常数1,故平衡向逆反应方向移动,所以答案是:逆反应;②平衡向正反应方向移动,浓度商小于平衡常数,即 ![]() <1,解得x<3.0,所以0≤x<3,所以答案是:0≤x<3.0;③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为a%<b%,所以答案是:小于. 分析:本题考查平衡常数的计算与运用,注意化学平衡常数只与温度有关,温度不变,化学平衡常数不变.
<1,解得x<3.0,所以0≤x<3,所以答案是:0≤x<3.0;③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为a%<b%,所以答案是:小于. 分析:本题考查平衡常数的计算与运用,注意化学平衡常数只与温度有关,温度不变,化学平衡常数不变.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】将BaCl2溶液加入某无色溶液后,生成白色沉淀,再加入稀HNO3 ,则沉淀不溶解。下列说法正确的是( )
A. 一定存在Ag+ B. 一定存在CO32-
C. 一定存在SO42- D. 以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se.
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2 , 且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的化学反应方程式
(2)已知:Se+2H2SO4(浓)═2SO2↑+SeO2+2H2O、2SO2+SeO2+2H2O═Se+2SO ![]() +4H+、SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 .
+4H+、SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 .
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO ![]() →Se+I2+KNO3+H2O②I2+2Na2S2O3═Na2S4O6+2NaI
→Se+I2+KNO3+H2O②I2+2Na2S2O3═Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目
(4)实验中,准确称量SeO2样品0.1500g,消耗0.2000molL﹣1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列叙述正确的是
A.氧化还原反应的本质是化合价发生变化
B.有单质产生的分解反应一定是氧化还原反应
C.氧化剂在同一反应中既可以是反应物,也可以是生成物
D.还原剂在反应中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )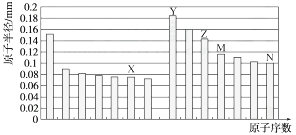
A.Z、N两种元素的离子半径相比,前者较大
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题: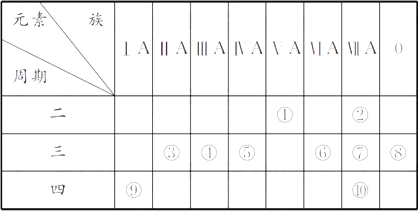
(1)⑤和⑧的元素符号分别是和。
(2)表中最活泼的金属是 , 非金属性最强的元素是(填元素符号,下同)。
(3)表中能形成两性氢氧化物的元素是 , 分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:。
(4)请设计一个实验方案,比较⑦和⑩的单质氧化性的强弱:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(g)+nB(g)pC(g)+qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v﹣t图象.下列判断正确的是( )

A.b1>b2 , t1>t2
B.两图中阴影部分面积一定相等
C.A的平衡转化率(Ⅱ)大于(Ⅰ)中A的转化率
D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于硅的叙述中,正确的是( )
A.粗硅制备单晶硅不涉及氧化还原反应
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.含有0.1 molL-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.含有0.1 molL-1 Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com