
| A. | 温度 | B. | 物质的量浓度 | C. | 规格 | D. | 刻度线 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
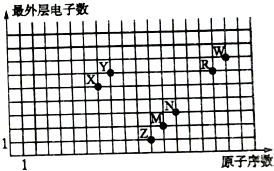
| A. | 元素对应的离子半径:Z>M>R>W | |
| B. | 简单氢化物的沸点:W>R>Y>X | |
| C. | 气态氢化物的稳定性:X>Y>R>W | |
| D. | Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
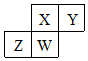 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Y、Z、W的最高化合价分别与其主族序数相等 | |
| C. | 最简单气态氢化物的热稳定性:H2Y>XH3>WH3>ZH4 | |
| D. | 最高价氧化物对应水化物的酸性:HXO3>H3WO4>H2ZO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减压 | B. | 降温 | C. | 加压 | D. | 增大B的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  CuSO4溶液 | B. |  ZnSO4溶液 | ||
| C. | 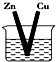 酒精 | D. | 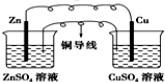 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y与Z形成的化合物都可以和盐酸反应 | |
| C. | 简单阴离子的还原性:Y>W | |
| D. | Z与Q形成的化合物水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | 30 | 30 | 30 | 30 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | 20 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com