
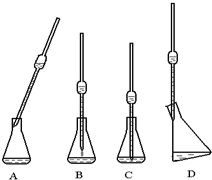
 某草酸晶体的化学式可表示为H2C2O4•xH2O,为测定x的值,进行下列实验:
某草酸晶体的化学式可表示为H2C2O4•xH2O,为测定x的值,进行下列实验:分析 (1)根据向锥形瓶中取液的基本实验操作判断;
(2)依据滴定发生的氧化还原反应离子方程式的定量关系计算得到;
解答 解:(1)图中所用的仪器是移液管,将移液管放入接受溶液的容器中,使出口尖端靠着容器内壁,容器稍倾斜,移液管则保持垂直,放开食指,使溶液沿容器内壁自然流下,待移液管内溶液流凈后,再等待15秒,取出移液管,留在管口的少量液体不要吹出,
故答案是:D;
(2)由题给化学方程式及数据可知,5H2C2O4+2MnO4-+6 H+═10CO2↑+2 Mn2++8 H2O,7.56g纯草酸晶体中含H2C2O4的物质的量为:0.600 mol/L×10.00 mL×10-3 L/mL×$\frac{5}{2}$×$\frac{100ml}{25ml}$=0.0600 mol,
则7.56g H2C2O4•xH2O中含H2O的物质的量为$\frac{7.56g-0.0600mol×90g/mol}{18g/mol}$=0.12 mol,0.0600mol晶体含水0.160mol,1mol晶体中含的结晶水2mol;则x=2.
故答案为:2.
点评 本题考查中和滴定实验,难度适中,注意掌握草酸含量的计算方法及中和滴定中的误差分析即可解答.


科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液在电流作用下电离出自由移动的离子 | |
| B. | 设阿伏加德罗常数为NA,则2.24LCO2气体中所含原子数目为0.3NA | |
| C. | 实验室里将少量金属钠保存在煤油中 | |
| D. | 向某无色溶液中加入少量BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则此溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
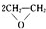
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Mg2+ | Cr3+ | Cl- |
| 浓度(mol/L) | 0.5 | 0.01 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 角鲨烯是一种脂质不皂化物,最初从角鲨烯的甘油中发现的,具有生物氧化还原作用与提高能量的效果,有利于增强机体的耐力与改善心脏功能,可用于癌症的防治,是一种无毒性的具有防病治病作用的海洋生物活性物质,关于角鲨烯有下列叙述:
角鲨烯是一种脂质不皂化物,最初从角鲨烯的甘油中发现的,具有生物氧化还原作用与提高能量的效果,有利于增强机体的耐力与改善心脏功能,可用于癌症的防治,是一种无毒性的具有防病治病作用的海洋生物活性物质,关于角鲨烯有下列叙述:| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
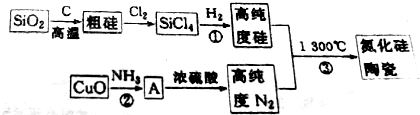
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
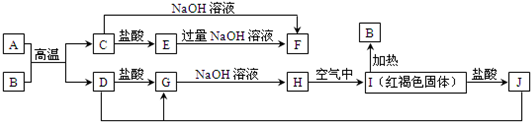
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com