
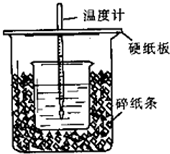
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
| B、四种溶液中,水的电离程度最大的是NaClO |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3 |
| D、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图装置用来电解饱和食盐水,C电极产生的气体能使湿润的淀粉KI试纸变蓝 |
B、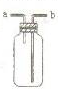 如图装置可用于收集H2、NH3、Cl2、HCl、NO2 |
C、 如图装置中X为苯,可用于吸收氮气或氯气 |
D、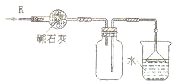 如图装置可用于干燥、收集氨气、并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| x值 | 剩余气体 | |
| 化学式 | 物质的量/摩 | |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应中氧化剂得电子,化合价升高 |
| B、氧化还原反应中,一种物质被氧化,另一种物质必然被还原 |
| C、元素化合价没有升降的反应,一定是非氧化还原反应 |
| D、氧化还原反应都是有单质参加的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置可用于测定中和热 |
B、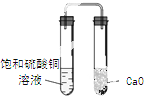 装置久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
C、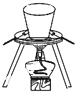 装置在胆矾中结晶水的测定实验中用于灼烧胆矾 |
D、 装置可用于吸收易溶于水的尾气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com