
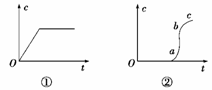
向含有H2SO4的H2O2溶液中滴加定量的KMnO4溶液,反应开始时,溶液中Mn2+的浓度c将随时间的变化而变化。某学生在做实验前认为,Mn2+的浓度c与时间t的关系如下图中①,做完实验后,得到的结果为下图中②,请说明下列问题:
(1)写出H2O2与KMnO4反应的化学方程式。
(2)Oa段的意义。
(3)ab段的意义及ab段很陡的原因。
(4)bc段的意义。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
下列关于0.15mol /L的Na2SO4溶液的说法中,正确的是( )。
A.1L溶液中含有Na+、SO42-总数为0.3NA
B.1L溶液中含有Na+数目是0.15NA
C.1 L溶液中Na+的浓度是0.3 mol/L
D.2 L溶液中含有SO42—的浓度是0.3mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )。
A.在FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.Ba(OH) 2溶液与硫酸的反应:OH-+H+ = H2O
C.在Al(OH) 3中滴加盐酸:Al(OH) 3+3H+ = Al3++3H2O
D.铁与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
|
T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0
查看答案和解析>>
科目:高中化学 来源: 题型:
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)  N2(g)+2CO2(g)。下列说法不正确的是(双选)( )
N2(g)+2CO2(g)。下列说法不正确的是(双选)( )
A.使用催化剂可以改变反应的ΔH
B.使用高效催化剂可有效提高正反应速率
C.使用催化剂能提高CO的反应速率和转化率
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g) 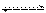 2C(g) ΔH<0,达到平衡后,将气体混合物的温度降低。下列叙述中正确的是( )
2C(g) ΔH<0,达到平衡后,将气体混合物的温度降低。下列叙述中正确的是( )
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都减小,平衡向正反应方向移动
D.正反应速率和逆反应速率都减小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是新型能源和重要化工原料。
 已知:①2CO(g)+O2(g)=2CO2(g)
已知:①2CO(g)+O2(g)=2CO2(g) 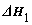 ; ②CH4(g)+2O2(g)=CO2(g)+2H2O(l)
; ②CH4(g)+2O2(g)=CO2(g)+2H2O(l) 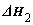
③H2(g)+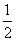 O2(g)=2H2O(l)
O2(g)=2H2O(l) 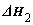
(1)科学家提出一种利用天然气制备氢气的方法:CH4(g)+CO2(g)=2CO(g)+2H2(g) 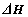
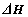 = 。这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是 。
= 。这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是 。
(2)氨气是重要化工原料,在国民经济中占重要地位。
①在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g) 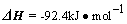
实验测得起始、平衡时的有关数据如下表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| I | 3 n | n | 0 | 放出热量a kJ |
| II | 3 n | 2 n | 0 | 放出热量b kJ |
| III | 6 n | 2 n | 0 | 放出热量c kJ |
下列判断正确的是 。
A.N2的转化率:II>I>III B.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:III>I D.平衡常数:III>II>I
②在密闭恒容容器中投入一定量氮气和氢气,混合气体中氨气体积分数和温度关系如图所示:
曲线TJ段变化主要原因是 ,JL段变化的主要原因是 。氨气正反应速率:T点 L点(填:大于、小于或等于)。
③在2 L密闭容器中充入一定量的氨气,氨气的物质的量与反应时间关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | ••• |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
在该条件下,前5分钟H2平均反应速率为 。
④常温下,在V mL的a mol·L-1稀硫酸溶液中滴加b mol·L-1稀氨水V mL恰好使混合溶液呈中性。此时,一水合氨的电离常数Kb= (用含a、b代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂的方法不正确的是
A.钠保存在煤油中 B.用棕色试剂瓶盛放新制的氯
C.用带玻璃塞的试剂瓶盛放NaOH溶液 D.向盛放氯化亚铁溶液的试剂瓶中加少量铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com