
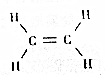
| A. | 乙烯是由碳、氢两种元素组成的 | |
| B. | 乙烯中碳元素的质量分数为85.7% | |
| C. | 乙烯是一种有机高分子化合物 | |
| D. | 乙烯中碳、氢两种元素的原子个数比是1:2 |
分析 A.根据图知,乙烯中含有C、H两种元素;
B.乙烯中C元素质量分数=$\frac{碳元素相对原子质量×原子个数}{乙烯相对分子质量}×100%$;
C.高分子化合物相对分子质量大于10000;
D.乙烯分子式为C2H4,据此判断C、H原子个数之比.
解答 解:A.根据图知,乙烯中含有C、H两种元素,所以乙烯是由C、H两种元素组成的,故A正确;
B.乙烯中C元素质量分数=$\frac{碳元素相对原子质量×原子个数}{乙烯相对分子质量}×100%$=$\frac{12×2}{12×2+1×4}$×100%=85.7%,故B正确;
C.高分子化合物相对分子质量大于10000,乙烯的相对分子质量是28,所以乙烯是小分子化合物,不是高分子化合物,故C错误;
D.乙烯分子式为C2H4,则C、H原子个数之比=2:4=1:2,故D正确;
故选C.
点评 本题以乙烯为载体考查元素质量分数计算、基本概念等知识点,为基础题,明确高分子化合物概念、元素质量分数计算方法是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 盐的组成中一定含有金属元素 | |
| B. | 金属一定能与酸反应产生氢气 | |
| C. | 由同种元素组成的纯净物一定是单质 | |
| D. | 同一化合物里同种元素的化合价一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:
砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电力平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | NaCN溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2=2HCN+CO${\;}_{3}^{2-}$ | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的甲酸溶液和氢氰酸溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
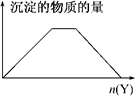
| A. | 向NaOH和Ca(OH)2的混合溶液中通入CO2 | |
| B. | 向HCl和AlCl3的混合溶液中滴加溶液 | |
| C. | 向KAl(SO4)2溶液中滴加NaOH溶液 | |
| D. | 向NH4Cl和MgCl2的混合溶液中滴加NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现.
现.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com