
已知Mg能在CO2气体中燃烧(CO2+2Mg  2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
求:(1)在足量CO2气体中,反应结束后所得固体的质量。
(2)在CO2和O2的混合气体中,反应后O2有剩余,则最终固体的质量为_______克。
(1)11.5 g(2) 10
解析试题分析:(1)Mg和CO2反应的化学方程式为:CO2 + 2Mg  2MgO + C n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g;m(C)="0.25" mol /2×12 g·mol-1="1.5" g 所以固体总质量为:10 g +1.5 g ="11.5" g (2)活动性O2> CO2。若反应后O2有剩余,说明只发生了反应:O2 + 2Mg
2MgO + C n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g;m(C)="0.25" mol /2×12 g·mol-1="1.5" g 所以固体总质量为:10 g +1.5 g ="11.5" g (2)活动性O2> CO2。若反应后O2有剩余,说明只发生了反应:O2 + 2Mg  2MgO。n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g。
2MgO。n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g。
考点:考查Mg的化学性质及反应的先后顺序的知识。


科目:高中化学 来源: 题型:填空题
0.5mol H2SO4的质量是________g,含______________个分子,含________mol氧原子,能和________mol NaOH完全反应,该硫酸所含氢元素的质量与________g中所含氢元素的质量相同。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在50mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)="3" mol·L-1。
(1)求稀释后的溶液的pH 。
(2)若生成的气体中NO2的物质的量为0.125 mol,则a=
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入2mol·L-1的NaOH恰好被吸收,求NaOH溶液的体积为 mL。生成的NaNO2为 mol。
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:
4NO + 4NH3 + O2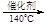 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3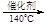 7N2 + 12H2O
7N2 + 12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为 (精确到0.01)。
②要处理5m3的尾气,需要氨氧混合气的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
铝及其化合物在生产生活中的应用广泛。
(1)Al4C3用于冶金及催化剂。与盐酸反应(产物之一是含氢量最高的烃)的化学方程式是: ;14.4g Al4C3与盐酸反应产生的气体是 L(标准状况)。
(2)AlN用于电子仪器。AlN中常混有少量碳,将一定量含杂质碳的AlN样品置于密闭反应器中,通入4.032L(标准状况下的)O2,在高温下充分反应后测得气体的密度为1.34g/L(已折算成标准状况,AlN不跟O2反应),则所得气体的摩尔质量为 g/mol,该气体的成分是 (写化学式),该样品中含杂质碳 g。
(3)氯离子插层镁铝水滑石是一种新型的离子交换材料。制备这种水滑石的过程是:MgCl2、AlCl3、NaOH、NaCl溶液,按一定比例混合,在65℃充分反应后,经过滤、洗涤、干燥得到该水滑石。为确定该水滑石的成分,进行如下操作:
①取26.65g样品,在高温下使其充分分解,得到金属氧化物和气体,气体依次通过足量的浓硫酸和浓氢氧化钠溶液,这两种液体分别增重9.9g和3.65g;将金属氧化物在无色火焰上灼烧,火焰仍无色。
②另取26.65g样品,加入足量的稀硝酸,使其完全溶解,再加入NaOH溶液至过量,最终得到11.6g白色沉淀。通过计算确定氯离子插层镁铝水滑石的化学式。
(4)氯离子插层镁铝水滑石在空气中放置,缓慢与CO2反应,部分氯离子会被碳酸根离子代替。26.65g样品在空气中放置一段时间后质量变为25.925g,则碳酸根离子代替部分氯离子的水滑石的化学式是 ,此过程的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
把1.0 mol·L-1 CuSO4和0.50 mol·L-1 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度c(CuSO4)=_______ c(H2SO4)="_________"
(2)混合液中H+、SO42-的物质的量浓度c(H+)=__________ c(SO42-)="_________"
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中Fe2+的物质的量浓度c(Fe2+)="___________________________"
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
实验室中用锌和稀硫酸反应制取氢气。
(1)要制取3.36L(标准状况)气体,需要1 mol/L H2SO4多少毫升?
(2)某同学用向下排空气法收集氢气,测得所收集气体密度是纯氢气密度的1.2倍。求该气体中氢气所占的体积分数(设空气的平均相对分子质量为29)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。请填空: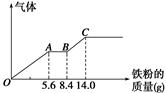
(1)AB段的反应的离子方程式为 ;
(2)原混合酸中NO3-物质的量浓度为 mol·L-1;
(3)原混合物中H2SO4物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
①按下图装配实验装置。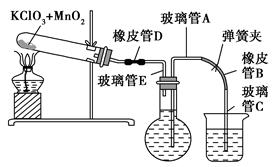
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致? 。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为 L;混合物中MnO2的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com