
分析 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,原子只能有2个电子层,最外层电子数为6,则C是O元素;C与F同主族,则F是S元素;D与E和F同周期,即处于第三周期,D是所在周期原子半径最大的主族元素,则D是Na元素;E的原子序数大于钠小于硫,所以E的单质是固体;六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素;A的单质是气体,则A的原子序数最小,所以A是H元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,其原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,原子只能有2个电子层,最外层电子数为6,则C是O元素;C与F同主族,则F是S元素;D与E和F同周期,即处于第三周期,D是所在周期原子半径最大的主族元素,则D是Na元素;E的原子序数大于钠小于硫,所以E的单质是固体;六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素;A的单质是气体,则A的原子序数最小,所以A是H元素,
(1)D是Na元素,钠原子核外有3个电子层,最外层有1个电子,所以其在元素周期表中的位置是第三周期第IA族,
故答案为:第三周期第IA族;
(2)电子层数越多离子半径越大,电子层结构相同的两种,核电荷数越大离子半径越小,所以C、D、F三种元素形成的简单离子的半径由大到小的顺序是:S 2->O 2->Na+,
故答案为:S 2->O 2->Na+;
(3)若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为:SiO2+2OH-=SiO3 2-+H2O,
故答案为:SiO2+2OH-=SiO3 2-+H2O;
(4)若E是金属元素,则为Al元素,铝和氧化铁能发生铝热反应,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,冶炼金属Al时,铝离子发生还原反应得到Al,故用石墨做电极,Al在阴极极得到,电解过程中,阳极反应:2O2--4e-=O2↑,碳与O2反应消耗碳,故阳极石墨需要不断补充,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;阴;阳极反应:2O2--4e-=O2↑,碳与O2反应消耗碳;
(5)由H、N、O三种元素以原子个数比4:2:3形成化合物X为NH4NO3,硝酸铵中所含化学键类型有离子键和共价键,土壤中含有NH4NO3中的阳离子在硝化细菌的催化作用下被氧气氧化为其阴离子,即得到硝酸根,根据电荷守恒应有氢离子生成,其离子方程式为:NH4++2O2 $\frac{\underline{\;硝化细菌\;}}{\;}$NO3-+H2O+2H+,
故答案为:离子键、共价键;NH4++2O2 $\frac{\underline{\;硝化细菌\;}}{\;}$NO3-+H2O+2H+.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,综合考查学生分析能力、逻辑推理能力及对知识的迁移运用,需要学生具备扎实的基础,难度中等.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:解答题
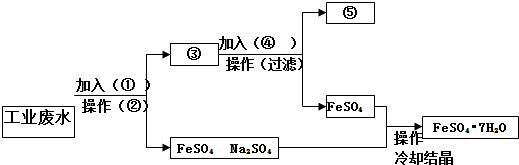
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一密闭容器中发生反应N2+3H2?2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
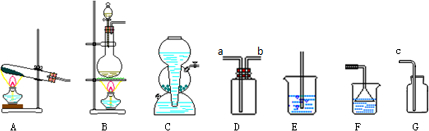
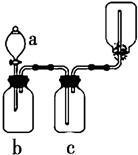 下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )
下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )| 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | 碳酸钙 | 浓硫酸 |
| A. | A | B. | B | ||
| C. | C D.D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
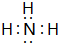 ;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有H2O2、N2H4(写出其中两种的化学式).
;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有H2O2、N2H4(写出其中两种的化学式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
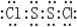 .Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl
.Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ?达到化学平衡时?4v正(O2)=5v逆(NO) | |
| B. | ?若单位时间内生成x mol NO的同时消耗x mol NH3?则反应达到平衡状态 | |
| C. | ?达到化学平衡时若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | ?当混合气体的压强不随时间变化时,此反应达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| B. | 室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2NA | |
| C. | 0.1molFe在0.1molCl2中充分燃烧,转移的电子数为0.3NA | |
| D. | 标准状况下,22.4LCCl4中含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com