
A、CO2的电子式 | ||
| B、N2的结构式N≡N | ||
C、质量数为37的氯原子
| ||
D、K+的结构示意图 |
 ,故A错误;
,故A错误;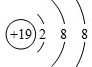 ,故D错误;
,故D错误;

科目:高中化学 来源: 题型:
| A、同一原子的能层越高,s电子云半径越大 |
| B、任一能层的能级总是从s能级开始,而且能级数等于该能层序数 |
| C、书写电子排布式时,按照构造原理,依据电子的填充顺序从左到右书写能级 |
| D、处于最低能量的原子叫做基态原子,我们通常所说的电子排布指的是基态原子的电子排布 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、键角是描述分子立体结构的重要参数 |
| B、键长等于两成键原子半径之和 |
| C、键能越大,键长越长,共价化合物越稳定 |
| D、键角的大小与键长、键能的大小无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第七周期可能有50种元素 |
| B、该原子的质量数为184 |
| C、该元素位于第七周期第ⅣB族 |
| D、该原子核外有114个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4、Na2O2晶体中的阴、阳离子个数比均为1:2 |
| B、离子化合物中一定不含共价键 |
| C、某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H8-2m+nR或RH8-2m+n |
| D、元素周期表中L层电子为奇数的元素的化合价也都是奇数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
235 92 |
| A、1mol此氧化物中含质子100mol |
| B、铀元素的相对原子质量为235 |
| C、U-235与U-238属于同一种核素 |
| D、1mol此氧化物所含中子数是阿伏伽德罗常数的159倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeBr2的溶液中,通入足量Cl2:2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、向NaAlO2 溶液中通入过量的CO2 制取Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| D、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH2=CH2与HCl反应制取CH3CH2Cl |
| B、CH4与Cl2反应制取CCl4 |
| C、苯与液溴反应制取溴苯 |
| D、乙醇与金属钠反应制取乙醇钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实际产生 |
| 理论产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com