
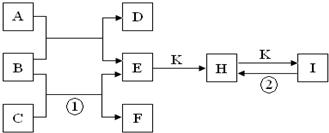
| 1 |
| 2 |
| ||
| ||
| 1 |
| 106 |
| 1 |
| 84 |


 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO��/mol?L-1 | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
| c��CO��/mol?L-1 | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
| ʵ���� | T/�� | NO��ʼŨ�� �� mol?L-1�� |
CO��ʼŨ�� �� mol?L-1�� |
�����ıȱ���� �� m2?g-1�� |
| �� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
| �� | 124 | |||
| �� | 350 | 124 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
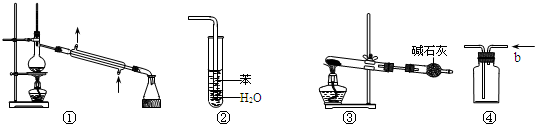
| A��װ�âٳ����ڷ��뻥�ܵ�Һ������ |
| B��װ�âڿ���������HCl���壬����ֹ���� |
| C����NH4ClΪԭ�ϣ�װ�âۿ�����ʵ�����Ʊ�����NH3 |
| D��װ�â�b�ڽ������ռ�H2��NH3������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| t/s | 0 | 500 | 1000 |
| c(N2O5/mol?L-1) | 5.00 | 3.52 | 2.48 |
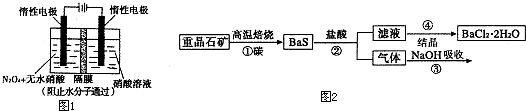
| c(Br-) |
| c(Cl-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
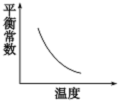 ���º�����2.5mol A�����2mol B����ͨ�����Ϊ2L���ܱ������з������·�Ӧ��2A��g��+B��g��?xC��g��+2D��s����2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.5mol B�������C��Ũ��Ϊ0.75mol?L-1���ӿ�ʼ��Ӧ���ﵽƽ��״̬����ϵ�뻷�����Ƚ���Ϊ72kJ���Ҹ÷�Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ��ͼ��ʾ��
���º�����2.5mol A�����2mol B����ͨ�����Ϊ2L���ܱ������з������·�Ӧ��2A��g��+B��g��?xC��g��+2D��s����2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.5mol B�������C��Ũ��Ϊ0.75mol?L-1���ӿ�ʼ��Ӧ���ﵽƽ��״̬����ϵ�뻷�����Ƚ���Ϊ72kJ���Ҹ÷�Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
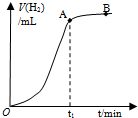 ijѧ��������Ϊag���߳�Ϊbcm�������ζ�п��Ƭ��������ᷴӦ�ⶨ�Ʋ��ȣ�����ʵ������ͼʾ�⣬��Ӧ��Ϻ���Ƭ����Ϊcg����֪п���ܶ�Ϊ��g/cm3������������������ǣ�������
ijѧ��������Ϊag���߳�Ϊbcm�������ζ�п��Ƭ��������ᷴӦ�ⶨ�Ʋ��ȣ�����ʵ������ͼʾ�⣬��Ӧ��Ϻ���Ƭ����Ϊcg����֪п���ܶ�Ϊ��g/cm3������������������ǣ�������| A��t1ʱ��п�Ʋ�����ȫ��Ӧ | ||
B��п�Ʋ�ĺ��Ϊ
| ||
| C����Ӧ����Ҳ��Ӱ��OA�εķ�Ӧ���ʵ�����֮һ | ||
| D����ԭ��ط�Ӧ�����������ĵ缫��ӦʽΪZn-2e-��Zn2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��22.4LNH3����������Ϊ10NA |
| B��7.8gNa2O2������CO2��Ӧת�Ƶ�������Ϊ0.2NA |
| C������£�11.2LCl2������NaOH��Ӧת�Ƶ�����ΪNA |
| D�����³�ѹ�£�16gO2��O3������庬��ԭ����ΪNA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com