
下列说法正确的是
A.理论上任何氧化还原反应都可以设计成原电池。
B.甲烷的标准燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)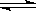 2NH3(g)△H=-38.6 kJ/mol
2NH3(g)△H=-38.6 kJ/mol
D.同温同压下,等量的氢气完全发生反应:H2(g)+Cl2(g)=2HCl(g),在点燃条件下放出的热量与光照条件下放出的热量相等。
科目:高中化学 来源:2017届内蒙古高三上第二次月考化学试卷(解析版) 题型:选择题
有四种混合溶液,分别由等体积0.1mol·L-1的2种溶液混合而成①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3。下列关于该四种混合溶液的各项排序正确的是
A.pH:②>③>④>①  B.c(CH3COO-):②>④>③>①
B.c(CH3COO-):②>④>③>①
C.c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>②
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.Cl2通往NaOH溶液中:Cl2+OH-=Cl-+ClO-+H2O
B.在苯酚钠溶液中通入少量的二氧化碳气体:C6H5O—+CO2+H2O=C6H5OH+HCO3—
C.将NaOH溶液滴入过量的Ca(HCO3)2溶液中:HCO3-+Ca2++OH—=CaCO3↓+H2O
D.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)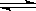 SO3(g)+NO(g),达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
SO3(g)+NO(g),达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
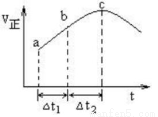
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)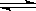 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中c(NH3)∶c(CO2)=2∶1
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:填空题
I、判斯正误.正确的划“√ ”,错误的划“×”:
(1)将NH4Cl溶液蒸干制备NH4Cl固体
(2)读取滴定管内液体的体积时,俯视读数导致读数偏小
(3)装待测液的锥形瓶用蒸馏水洗净后,用待测液润洗可使滴定结果更准确
(4)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
II、现有十种物质:①酒精;②氯化铵;③氟化氢;④氨水;⑤磷酸;⑥碳酸氢钠;⑦稀硫酸;⑧硫酸钡;⑨二氧化碳;⑩石墨。用序号填空:
(1)属于强电解质的是__________________;
(2)属于弱电解质的是__________________;
(3)属于非电解质的是__________________;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
把0.05molNaOH固体分別加入下列100mL溶液中,溶液的导电能力变化不大的是
A.自来水 B.0.5 mol·L-1KOH 溶液
C.0.5 mol·L-1醋酸 D.0.5 mol·L-1NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上月考二化学卷(解析版) 题型:填空题
在常温下,下列五种溶液:
①0.1mol/L NH4Cl溶液
②0.1mol/L CH3COONH4溶液
③ 0.1mol/L NH4HSO4溶液
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合溶液
⑤0.1mol/L NH3·H2O溶液
请根据要求填写下列空白:
(1)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 (填序号)
(2)比较溶液②、③中c(NH4+)的大小关系是② ③(填“>”、“<”或“=”)
(3)在溶液④中, 的浓度为0.1mol/L;NH3·H2O和 的物质的量浓度之和为0.2 mol/L
(4)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度_________(填“>”、“<”或“=”) NH4+ 的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
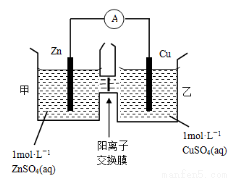
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com