
【题目】20℃时,将足量的BaSO4固体溶于50mL水中,充分搅拌,慢慢加入Na2CO3固体,搅拌,溶液中随c(CO32-)增大时c(Ba2+)变化曲线如下图。则下列说正确的是
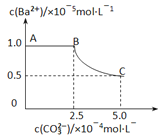
A. 20℃时Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(CO32-):c(SO42-)=25
【答案】D
【解析】A.当溶液中c(CO32-)=2.5×10—4mol/L时,溶液中Ba2+的浓度没有下降,则此时c(Ba2+)=c(SO42-)=1.0×10-5mol/L,故BaSO4的Ksp= c(Ba2+)×c(SO42-)=1.0×10-5×1.0×10-5 =1.0×10-10,BaCO3的Ksp= c(Ba2+)×c(CO32-)=1.0×10-5×2.5×10-4=2.5×10-9,所以20℃时,Ksp(BaSO4)<Ksp(BaCO3),故A错误;B. 由图可知,开始加入Na2CO3固体时,溶液中Ba2+的浓度并没有下降,因此开始时没有BaCO3固体生成,故B错误;C. 由A项分析可知,BaCO3的Ksp=2.5×10-9,故C错误;D . 曲线BC段内,BaCO3和BaSO4在溶液中都达到了平衡状态,则![]() =
= ![]() =
= ![]() =
=![]() =25,故D正确;答案选D。
=25,故D正确;答案选D。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】将牛奶和姜汁混合,待牛奶凝固便成为一种富有广东特色的甜品﹣﹣姜撞奶。为了掌握牛奶凝固所需的条件,某同学在不同温度的等量牛奶中混人一些新鲜姜汁,观察混合物15min,看其是否会凝固,结果如下表。请回答下列问题:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
结果 | 15min后仍未有凝固迹象 | 14min内完全凝固 | 1min内完全凝固 | 1min内完全凝固 | 15min后仍未有凝固迹象 |
(注:用曾煮沸的姜汁重复这项实验,牛奶在任何温度下均不能凝固)
(1)实验证明新鲜姜汁中含有一种酶,其作用是__。
(2)20℃和100℃时,15min后仍未有凝固迹象,说明酶的活性较低,其原因分别是__和__。
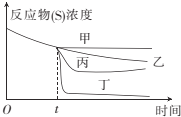
(3)若60℃时牛奶在有姜汁和没有姜汁的情况下都可以凝固,当反应进行到t时,向其中加人姜汁。如图,图中能正确表示加姜汁后牛奶凝固随时间变化趋势的曲线是__。
(4)为提高实验的准确度,实验中“不同温度的等量牛奶中混入一些新鲜姜汁”操作中应注意的是__。
(5)有同学说,该实验不能得出姜汁使牛奶凝固的最适温度,请提出解决方案:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中,常将溶液或试剂进行酸化,下列试剂选择和酸化处理正确的是( )
A.定性检验SO ![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化
C.检验某溶液中是否含Cl﹣ , 用HNO3酸化的AgNO3溶液
D.配制FeCl2溶液时通常加少量HNO3酸化,以避免其变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题: 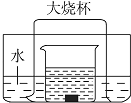
(1)实验过程中,观察到的主要现象是: ①;②;③;④ .
(2)用该装置做铜与浓硝酸反应的实验,最突出的优点是 .
(3)若要验证最终得到的气体生成物,最简便的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,用0.1000mol/LCH3COOH溶液滴定NaOH溶液,达到滴定终点时,溶液中各离子浓度从大到小的顺序为________;为了减小滴定误差在滴定实验中使用的酸碱指示剂最好是________(填序号)
A、石蕊 B、甲基橙 C、酚酞 D、甲基橙或酚酞
(2)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为C1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为C2,则C1/C2=________。
(3)已知H2A的电离方程式为:H2A=H++HA-;HA-![]() H++A2-。试判断H2A是_________(填“强”“弱”)电解质。
H++A2-。试判断H2A是_________(填“强”“弱”)电解质。
(4)已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂。则CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是________。
(5)电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为__________________(用化学式表示)。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-l
已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-l
②K2S(s)=S(s)+2K(s) △H=bkJ·mol-l
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H=ckJ·mol-l
下列说法正确的是
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol 碳(s)在空气中不完全燃烧生成CO的焓变小于akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向lL0.lmol·L-1一元酸HR溶液中逐渐通人氨气[已知常温下Kb(NH3H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如右图所示。下列叙述正确的是

A. 0.1 mol·L-1HR溶液的pH约为3
B. HR为弱酸,常温时Ka (HR) =1×l0-7
C. 当通入0.1molNH3 时,c(R-) >c(NH4+)
D. 当c(HR) =c(R-)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步实验直接完成的是
A. Al―→Al3+ B. Al―→AlO2-
C. Al3+―→Al(OH)3 D. Al2O3―→Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偶氮苯是橙红色晶体,溶于乙醇,微溶于水,实验室制取反式偶氮苯的步骤如下:
步骤一:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,装上冷凝管,加入少量镁粉,立即发生反应。等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
步骤二:将所得液体趁热倒入冰水中,并不断搅拌,用冰醋酸小心中和至pH 为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
步骤三:用95%的乙醇重结晶。
(1)步骤一中反应不需要加热就能剧烈进行,原因是____________。镁粉分两次加入的原因是______________。
(2)步骤二中析出固体用冰水洗涤的原因是______________。若要回收甲醇,实验所需的玻璃仪器除冷凝管、酒精灯、牛角管和锥形瓶外还应有___________。
(3)取0.1g偶氦苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1cm处,再将滤纸条末端浸入裝有1: 3 的苯-环己烷溶液的容器中,实验操作及现象如图所示。
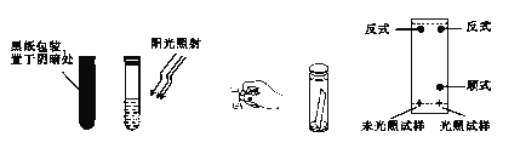
①实验中分离物质所采用的方法是_______法。
②由实验结果可知:_______;利用该方法可以提纯反式偶氮苯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com