
已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32- 、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
A.肯定不含I- B.肯定不含SO42- C.可能含有SO32- D.肯定含有NH4+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年甘肃省通渭县高二下期末理综化学试卷(解析版) 题型:实验题
[化学——选修2化学与技术]高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂=其生产工艺如下:
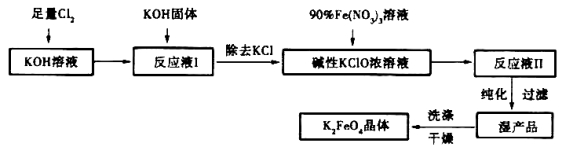
已知:①2KOH + Cl2 = KCl + KClO + H2O(条件:温度较低)
②6KOH + 3C12 = 5KCl + KClO3 +3H2O(条件:温度较高)
③2Fe(NO3)3 +2KC1O + 10KOH = 2K2FeO4 + 6KNO3 +2KCl + 5H2O
回答下列问题:
(1)该生产工艺应在_______(填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式_________________________;
(3)K2FeO4可作为新型多功能水处理剂的原因____________________;
(4)配制KOH溶液时,是在每100mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为__________
(5)在“反应液I”中加KOH固体的目的是
①_______________,
②______________________________;
(6)从“反应液II”中分离出K2FeO4后,副产品是__________ (写化学式)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷(解析版) 题型:填空题
(1)用零价铁(Fe)去除水体中的硝酸盐(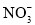 )已成为环境修复研究的热点之一。Fe还原水体中
)已成为环境修复研究的热点之一。Fe还原水体中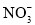 的反应原理如右图所示。
的反应原理如右图所示。
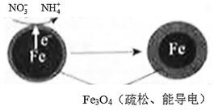
①作负极的物质是________。②正极的电极反应式是________ _。
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)  CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)  CO(g) +H2O(g) △H3
CO(g) +H2O(g) △H3
已知反应①中相关的化学键键能数据如下:
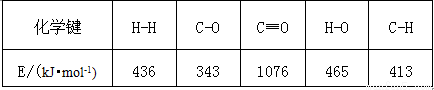
由此计算△H1= kJ·mol-1.已知△H2= –58kJ·mol-1,则△H3= kJ·mol-1.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷(解析版) 题型:选择题
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极区反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷(解析版) 题型:选择题
已知:H2O(g)===H2O(l) ΔH1=Q1 kJ/mol①
C2H5OH(g)===C2H5OH(l) ΔH2=Q2 kJ/mol②
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=Q3 kJ/mol③
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5Q1-1.5Q2+0.5Q3
D.1.5Q1-0.5Q2+0.5Q3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷(解析版) 题型:选择题
下图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是
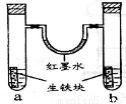
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中负极电极反应相同
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆实验中学高二下期末化学试卷(解析版) 题型:选择题
已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O 和未知物X.下列说法中正确的是
A.该未知物X为NaI
B.该反应中氧化剂与还原剂的物质的量之比为5:2
C.该反应中,发生氧化反应的过程是KIO3→I2
D.由反应可知还原性强弱顺序为:Na2SO3>I2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海乐都一中高二下期末化学试卷(解析版) 题型:选择题
下列有关电解质溶液的说法正确的是
A.向0.1mol•L-1CH3COOH溶液中加入少量水,溶液中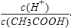 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中 增大
增大
C.向盐酸中加入氨水至中性,溶液中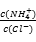 >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中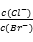 不变
不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com