
【题目】下列物质在常温下能导电的是
A. 氯化钠晶体 B. 酒精 C. 硫酸 D. 石墨
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】I.大气中CO2含量的增多会导致地球表面温度升高及海洋生态环境改变。
已知:CO2(g)+CaO(s)![]() CaCO3 (s)
CaCO3 (s)
(1) 某研究小组在实验室探究不同温度对CaO吸收CO2效率的影响。在体积相同的密闭容器中,均充入一定量的生石灰和足量CO2,在不同温度下,保持其它初始实验条件不变,发生如上平衡分别在t秒时测定CO2的浓度(mol/L) 如图。

①该反应在__________条件下能自发进行。
A.较高温度 B.较低温度 C.任何温度 D.任何温度下均不能
②A、B、C、D、E五点中,达到化学平衡状态的点是_____________。
(2)在恒定温度下,一个体积固定为1L的容器中加入20gCaO和一定量的CO2气体,在10分钟达平衡的过程中CO2浓度变化如图所示,为提高CO2的吸收率,下列可以采取的措施有__________。
A.缩小反应容器的容积 B.升高温度
C.平衡体系中及时分离出部分CaCO3 D.使用合适的催化剂
若保持平衡时的温度不变,15分钟时将体积迅速增大至2L,在20分钟时重新达到平衡,请在下图中补充体积变化后CO2浓度变化示意图_______。

Ⅱ.在容积可变的密闭容器中发生反应:mA(g)+nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)mol·L-1 | 0.08 | 0.20 | 0.44 |
(3)当压强为1×106Pa时,此反应的平衡常数表达式:_________________________。
(4)电浮选凝聚法是工业上采用的一种污水处理方法,右图是该方法处理污水的实验装置示意图,实验过程中,污水的pH始终保持在5.0-6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。

阳极区生成沉淀的总电极反应为:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②③设计成如下图所示操作。
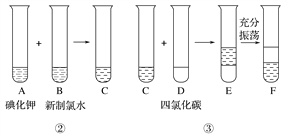
已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①_____________ ③_____________
(2)四氯化碳是________色、密度比水________的液体。F中下层液体的颜色为________色,上层液体中溶质的主要成分为________。(填化学式)
(3)从F中得到固态碘还需进行的操作是___________________________。
(4)在灼烧过程中,使用到的实验仪器有(除泥三角外)_______________(填序号)。
①试管 ②瓷坩埚 ③坩埚钳 ④蒸发皿 ⑤酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到目的的是( )
A.用碱石灰干燥氯气
B.用品红溶液鉴别CO2和SO2
C.用乙醇萃取碘水中的碘单质
D.用澄清石灰水检验碳酸钠溶液中是否含有碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。NaClO2在溶液中可生成ClO2、HClO2、ClO2-、Cl-等四种含氯微粒,经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是

A. 亚氯酸钠在碱性条件下较稳定
B. 25℃时,HClO2的电离平衡常数的数值Ka=10-6
C. 25℃,pH=3时NaClO2溶液中c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. 若浓度均为0.1mol/L的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,溶液中有关微粒的浓度由大到小的顺序为c(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com