
|
在c(H+)∶c(OH-)=1∶2的水溶液中能大量共存的离子组是 | |
| [ ] | |
A. |
K+、Al3+、H2PO4-、SO42- |
B. |
Ca2+、NH4+、CO32-、Cl- |
C. |
Na+、K+、NO3-、ClO- |
D. |
Na+、Ba2+、I-、SO32- |
科目:高中化学 来源: 题型:阅读理解
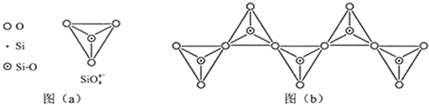
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ?mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
4- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
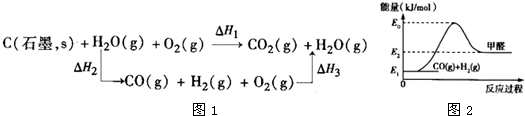
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物在反应中常有原子问的共价键全部或部分断裂,如C-H、C-C、C=C、C-0、C=O等.下列各反应中,反应物分子中断裂键的正确组合是( )
|
查看答案和解析>>
科目:高中化学 来源:09-10学年昆明三中高一下学期期末化学试卷 题型:选择题
有机物在反应中,常有下列原子间的共价键全部或部分断裂,如C—H、C—C、C=C、C—O、C=O、O—H等。下列各反应中,反应物分子中断裂键的排列,正确的组合是
|
化学反应 |
加成反应 |
乙酸酯化 |
乙醇酯化 |
乙醇的催化氧化 |
|
A |
C=C |
C—O |
O—H |
C—H、O—H |
|
B |
C=C |
C—O |
O—H |
C—O |
|
C |
C—C |
C=O |
C—O |
C—H |
|
D |
C=C |
C—O |
C—O |
C—C |
查看答案和解析>>
科目:高中化学 来源:期末题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com