
下列关于Fe2(SO4)3的叙述正确的是(设NA为阿伏加德罗常数的数值)
A.1mol/L的 Fe2(SO4)3溶液中含有2NA个Fe3+(不考虑水解)
B.1mol的 Fe2(SO4)3和S2-反应可转移2NA个电子
C.在该溶液中,K+、NH4+、I-、SO42-可以大量共存
D.与Cu反应的离子方程式为:Fe3++Cu = Fe2+ + Cu2+
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:2015届山东省高三上学期第一次(10月)检测化学试卷(解析版) 题型:选择题
水做还原剂的氧化还原反应是
A.氯气和水的反应:Cl2+H2O===HCl+HClO
B.氟气和水的反应:2F2+2H2O===4HF+O2
C.氧化钙和水的反应:CaO+H2O===Ca(OH)2
D.电解食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)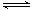 N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B |
|
|
升高温度,NO2的含量减小 | 0~3 s内,反应速率为 v(NO2)=0.2 mol·L-1 |
C | D |
|
|
t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x可能为压强 |
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:选择题
氯化亚砜(SOCl2,结构式如图)主要用于制造酰基氯化物,其工业制备原理:SO3+SCl2=SOCl2+SO2,
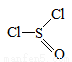
下列有关说法正确的是
A.SCl2和SOCl2中S的化合价分别为+2、+4价
B.制备反应中,二氧化硫是氧化产物
C.每消耗1mol SCl2,转移1mol电子
D.SOCl2分子中既含有离子键又含有共价键
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:选择题
根据表中信息,判断下列叙述中正确的是
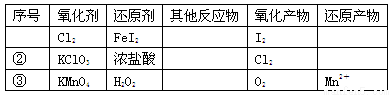
A.表中①组的反应中氧化产物一定是I2
B.氧化性强弱的比较:KClO3>Cl2>Fe3+>I2
C.表中②组每生成1molCl2,转移1mol电子
D.表中③组其他反应物可以为浓盐酸
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三期中考试化学试卷(解析版) 题型:填空题
(13分)雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某兴趣小组收集了该地区的雾霾,试样溶液经必要的预处理后,设计并完成了如下的实验:
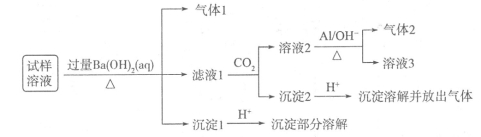
已知:NO3-+A1+OH-+H2O→NH3↑+[Al(OH)4]-,根据以上的实验操作与现象,回答下列问题:
(1)气体l的成分可能是 ,进一步确定该气体成分的方法是 ,
实验室制备该气体的方程式为 。
(2)写出沉淀2产生气体的离子方程式 。
(3)经过以上实验可知,该地区雾霾中一定存在的离子有 。
(4)某同学采用了另外一种实验方法,取少量的试样直接加入硝酸银溶液产生白色沉淀,该同学由此就确定一定含有Cl-,你认为他的说法是否合理 (填是或否),其理由是 。
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三期中考试化学试卷(解析版) 题型:选择题
已知:①Na3N+3H2O===3NaOH+NH3↑,②NaH+H2O===NaOH+H2↑下列叙述正确的是
A.离子半径:N3->Na+>H+
B.反应①和②都是氧化还原反应
C.反应①和②氧化剂都是H2O
D.Na3N和NaH与盐酸反应都只生成一种盐
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:选择题
已知: ①向KMnO4溶液中滴加浓盐酸,产生黄绿色气体; ②向KBr溶液中通入少量实验①产生的气体,溶液变黄色; ③取实验②生成的溶液少量滴在FeCl2与KSCN的混合溶液中,溶液变血红色。根据以上实验,下列判断正确的是
A.上述实验中,共有两个氧化还原反应
B.上述实验证明还原性:Fe2+>Br->Cl-> Mn2+
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验③证明Fe2+既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三11月阶段模块考试化学试卷(解析版) 题型:选择题
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3 +3ClO—+4OH— =2FeO42— +3Cl— +5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
则下列有关说法不正确的是
A.高铁酸钠中铁显+6价
B.湿法中FeO42—是氧化产物
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com