


科目:高中化学 来源: 题型:
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、过滤时,玻璃棒与三层滤纸一侧接触 |
| C、蒸发结晶时,应将溶液蒸干 |
| D、称量时,称量物放在托盘天平的左盘,砝码放在托盘天平的右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:
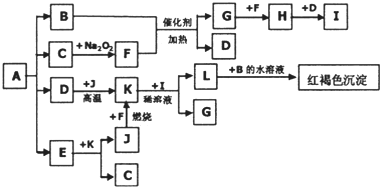
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 应取浓硫酸的体积/ml | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com