
【题目】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数![]() (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。
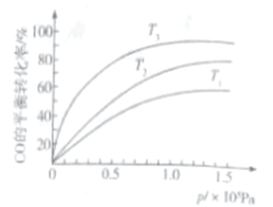
【答案】 ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O 2.0×10-2 20 4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) ΔH=-260kJ·mol-1 混合气体的密度或混合气体的平均相对分子质量或任一组分的体积分数等 33.3%或1/3 0.231/P02 T1>T2>T3
【解析】(1)①本题考查氧化还原反应方程式的书写,NaClO3中Cl化合价由+5价→-1价,化合价降低6价,Fe2+被氧化成Fe3+,化合价升高1价,最小公倍数为6,由:ClO3-+6Fe2+→Cl-+6Fe3+,溶液显酸性,根据原子守恒,离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;②本题考查化学计算,从电荷守恒和得失电子数目守恒入手,根据电荷守恒,2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-),代数数值,c(Fe2+)=2×10-2mol·L-1,Fe2+转化成Fe3+,失去1mol电子,因此溶液中共转移电子物质的量为1×103×2×10-2×1mol=20mol;(2)本题考查盖斯定律的应用,①+4×②-③×2得出:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=(-1648-4×393+2×1480)kJ·mol-1=-260kJ·mol-1;(3)本题考查达到化学平衡状态的判断、化学平衡的计算、影响化学反应速率的因素,①反应前后气体的物质的量不变,因此当气体物质的量不再改变,说明反应达到平衡;根据密度的定义,是恒压状态,气体体积改变,即当密度不再改变,说明反应达到平衡;根据化学平衡状态的定义,当某一组分的体积分数不再改变,说明反应达到平衡等;②CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)
CH4(g)+ H2O (g)
起始: 1 3 0 0
变化: x 3x x x
平衡: 1-x 3-3x x x ,达到平衡时,CO的体积分数为0.2,即有(1-x)/(1-x+3-3x+x+x)=0.2,解得x=1/3,CO的转化率为1/3,达到平衡氢气的体积分数为(3-3x)/(4-2x)=3/5,同理CH4的体积分数为1/10,H2O的体积分数为1/10,是恒压状态,CO的气体分压是P0×0.2,H2的气体分压是3P0/5,CH4、H2O的气体分压是P0/10,根据化学平衡常数的定义,K=p(CH4)×p(H2O)/根据化学平衡常数的定义,K=p(CH4)×p(H2O)/[p3(H2)×p(CO)],代入数值,K=0.231/P0;③正反应是放热反应,升高温度,平衡向逆反应方向移动,CO的转化率降低,即T1>T2>T3。


科目:高中化学 来源: 题型:
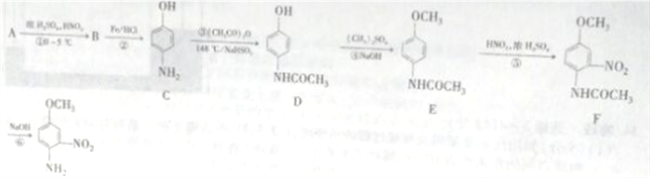
【题目】4-氨基-3硝基苯甲醚是合成类风湿关节炎治疗药物艾拉莫德的主要原料。4-氨基-3-硝基苯甲醚的合成路线如下:
已知: NH2(有弱碱性,易被氧化)
NH2(有弱碱性,易被氧化)
回答下列问题:
(1)A的结构简式为_______________,B的名称是_______________。
(2)反应②的反应类型是____________。
(3)C中官能团的名称是_________________。
(4)写出反应③的化学方程式:________________,反应③温度较高,若不加NaHSO3会导致反应混合体系的颜色明显不同,可能的原因是________________。
(5)写出反应⑥的化学方程式:______________________。
(6)H是E的同分异构体,则满足下列条件的结构有____种(不考虑立体异构),其中核磁共振氢谱中有4组峰,且峰面积比为1:2:2:6的结构简式为_____________。
①含有 结构且能发生银镜反应
结构且能发生银镜反应
②N原子直接与苯环相连,且结构中不存在N—O键;
③苯环上有两个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下、一定体积条件下,能说明下列反应达到平衡状态的是
A.反应2SO2(g)+O2(g)![]() 2SO3(g) 容器内的密度不随时间变化
2SO3(g) 容器内的密度不随时间变化
B.反应A2(g)+B2(g)![]() 2AB(g)容器内A2的消耗速率与AB消耗速率相等
2AB(g)容器内A2的消耗速率与AB消耗速率相等
C.反应N2+3H2![]() 2NH3容器内气体平均相对分子质量不随时间变化
2NH3容器内气体平均相对分子质量不随时间变化
D.反应4A(s)+3B(g)![]() 2C(g)+D(g)容器内气体总压强不随时间变化
2C(g)+D(g)容器内气体总压强不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO![]() 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
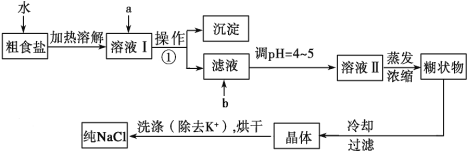
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀盐酸。
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO![]() ,选出a所代表的试剂,按滴加顺序依次为____________________ (只填化学式)。
,选出a所代表的试剂,按滴加顺序依次为____________________ (只填化学式)。
(2)如何检验 SO![]() 是否沉淀完全 。
是否沉淀完全 。
(3)调节pH 的目的 ,试剂b是 (填名称)。
(4)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________,使用该试剂的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某组同学为探究草酸浓度对该反应速率的影响,设计下列对照实验:
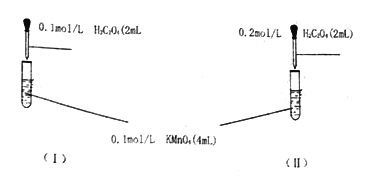
(1)写出上述反应的离子方程式____________。
(2)根据所学知识,你预期的实验现象是:_______(填“l”或“Ⅱ”)中紫色先褪去
(3)实验时,他们发现反应速率的变化从开始后的一段时间内,变化趋势如图,已知反应过程中温度基本不变,分析:
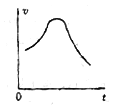
① 反应开始时,速度加块的原因为________;
② 后期反应速度下降的原因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色透明的溶液中,可以大量共存的离子组是
A. K+、NO3ˉ、OHˉ、Clˉ B. SO42-、Al3+、NH4+、Na+
C. Iˉ、Ba2+、Mg2+、NO3ˉ D. Clˉ、SCNˉ、K+、Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com