
分析 (1)结合热化学方程式书写方法,标注物质聚集状态和对应焓变;液态水变为气态水吸热;
(2)水煤气中主要成分是CO和H2,二者的体积比为l:l,l mol CH4气体完全燃烧生成CO2气体和气态水放出802kJ热量,结合热化学方程式计算热量之比;
(3)相同物质的量的天然气和水煤气,天然气燃烧放出的热量多,燃烧产生的污染少.
解答 解:(1)1mol H2完全燃烧生成液态水放出286kJ热量,所以H2完全燃烧生成气态水的热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1;1mol CH4气体完全燃烧生成CO2气体和液态水放出890kJ热量,液态水变为气态水吸热,所以相同条件下,1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量小于890kJ;
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1;<;
(2)依据热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol;2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol;水煤气中主要成分是CO和H2,二者的体积比为l:l,1molCH4燃烧放热890kJ,1molCO、H2混合气体放热$\frac{283+286}{2}$kJ=284.5kJ,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为$\frac{Q}{284.5}$:$\frac{Q}{890}$=3.1:1,燃烧生成的CO2的质量比约为$\frac{3.1×\frac{1}{2}×44}{1×44}$=1.55:1;
故答案为:3.1:1;1.55:1;
(3)以上数据和计算说明,相同物质的量的天然气和水煤气,天然气燃烧放出的热量多,即热值高,燃烧产生的温室气体CO2少,故答案为:热值高,污染小.
点评 本题主要考查了热化学方程式书写,反应热量的计算应用,燃烧特征的比较分析,注意反应中的热量与物质的量成正比,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
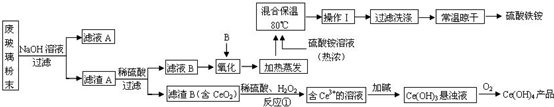

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于硫酸氢钠溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| C. | FeI2溶液中通入过量Cl2:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 上层溶液显橙红色 | 原溶液中有Br- |
| C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈紫色 | 原溶液中有K+ |
| D | 滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 澄清的石灰水与稀盐酸反应:OH-+H+═H2O | |
| C. | 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-═AgCl↓+NO3- | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 定容时仰视刻度线 | B. | 转移溶液后未洗涤烧杯和玻璃棒 | ||
| C. | 定容时俯视刻度线 | D. | 移液前容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 0.1 | 0.2 | 0 |
| 平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
| A. | 前3 min内,用Y的变化量表示的平均反应速率v(Y)=0.05mol•L-1•min-1 | |
| B. | 反应达到平衡时,X的转化率为50% | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 反应可表示为X+3Y?2Z,其平衡常数为1600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com