
| A. | 4Fe2++2I-+3Cl2═4Fe3++I2+6Cl- | |
| B. | 2I-+Cl2═2Cl-+I2 | |
| C. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl- |
分析 化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子;通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,据此回答.
解答 解:还原性I->Fe2+>Br-,向含等物质的量浓度的FeI2、FeBr2混合溶液中通人适量氯气,通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子;
A、当碘化亚铁全部被氧化时,碘离子和亚铁离子按照物质的量之比是2:1进行反应,发生反应4Fe2++2I-+3Cl2═4Fe3++I2+6Cl-,故A正确;
B、通入氯气后,碘离子先被氧化,即2I-+Cl2═2Cl-+I2,故B正确;
C、物质的量都是1mol的FeI2、FeBr2混合溶液中当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故C正确;
D、当碘化亚铁全部被氧化时,碘离子和亚铁离子按照物质的量之比是2:1进行反应,否则不会轮到溴离子被氧化,所以2Fe2++2I-+2Br-+3Cl2═2Fe3++I2+Br2+6Cl-中,溴离子被氧化了,亚铁离子和碘离子的物质的量之比不可能是1:1,故D错误.
故选D.
点评 本题考查氧化还原反应中氧化性和还原性强弱的知识,综合性较强,题目难度较大,解答本题时注意根据离子的还原性强弱判断反应的先后顺序和各离子的物质的量,为解答该题的关键,也是易错点,答题时注意体会.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
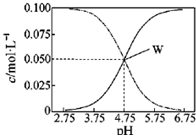 25℃,有c(CH3COOH)+c(CH3COO-)=0.l mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.l mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )| A. | pH=5.5溶液中:c(CH3COO->c(CH3COOH)>c(H+)>c(OH一) | |
| B. | W点表示溶液中:c(Na+)=c(CH3COO-) | |
| C. | pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)=0.l moL/L | |
| D. | 向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23gNa与足量H2O反应完全后失去2NA个电子 | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含2NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去9NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 5种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于p% | B. | 大于p% | C. | 小于p | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
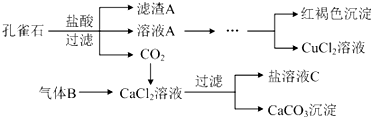
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
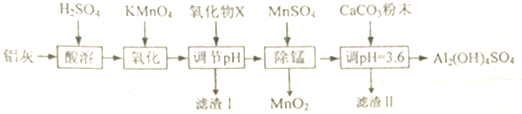
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com