
| 实验步骤 | 实验现象 |
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色. |
| 2.向新制得的Na2S溶液中滴加少量新制的氯水 | B.有气体产生,溶液变成浅红色 |
| 3.将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| 4.将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| 5.将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 |
分析 (1)根据实验方案可知实验目的,①③④⑤是同一实验目的,②可说明另一实验目的;
(2)根据实验条件和实验药品的性质结合实验操作判断所需仪器;
(3)根据实验现象来判断实验方案及发生的化学反应;
(4)根据氢氧化镁不能与氢氧化钠反应,而氢氧化铝与氢氧化钠反应来解答;
(5)根据实验现象比较金属性、非金属性的强弱,分析实验的结论;
解答 解:(1)由实验方案①③④⑤可验证金属的活泼性,②可验证非金属的活泼性,即实验目的为证明同周期元素金属性,非金属性递变规律(或证明第三周期元素金属性,非金属性性递变规律或证明Na、Mg、Al金属性强弱及S、Cl非金属性强弱,
故答案为:探究同一周期主族元素性质的递变规律;
(2)钠与滴有酚酞试液的冷水反应,一般应在烧杯中进行;做镁带、铝条与2mol/L的盐酸反应,一般要在试管中进行;向新制得的Na2S溶液中滴加少量新制的氯水,需要胶头滴管;
故答案为:烧杯;试管;胶头滴管;
(3)由A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色可知,该现象对应方案③钠与滴有酚酞试液的冷水反应,离子反应为:2Na+2H2O=2Na++2OH-+H2↑;
由B.有气体产生,溶液变成浅红色可知,该现象对应的方案为①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞,离子反应为:Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+H2↑;
由C.反应不十分剧烈,产生无色气体,该现象对应的方案为⑤将铝条投入稀盐酸中,离子反应为:2Al+6H+=2Al3++3H2↑;
由D.剧烈反应,产生大量无色气体可知,该现象对应的方案为④将镁条投入稀盐酸中,离子反应为:Mg+2H+=Mg2++H2↑;
由E.生成淡黄色沉淀可知,该现象对应的方案为②向新制得的Na2S溶液中滴加少量新制的氯水,发生的离子反应为:S2-+Cl2=2Cl-+S↓;
故答案为:
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | B | Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+H2↑ |
| 2 | E | S2-+Cl2=2Cl-+S↓ |
| 3 | A | 2Na+2H2O=2Na++2OH-+H2↑ |
| 4 | C | Mg+2H+=Mg2++H2↑ |
| 5 | D | 2Al+6H+=2Al3++3H2↑ |
点评 本题是综合考查了同周期元素性质的递变规律的探究,题目难度不大,培养了学生分析和解决问题的能力,注意物质的性质以及元素周期律的递变规律的运用.


科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | 2CH2CH2OH$→_{△}^{Cu}$2CH3CHO+H2O | ||
| C. | CH4+Cl2$\stackrel{光}{→}$CH2Cl+HCl | D. | CH2═CH2+H2$\stackrel{催化剂}{→}$CH3-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组,拟探究和比较SO2和 Cl2的漂白性,设计如图所示的实验装置二套.请你参与探究并回答下列问题.
某化学兴趣小组,拟探究和比较SO2和 Cl2的漂白性,设计如图所示的实验装置二套.请你参与探究并回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O. +Br2→
+Br2→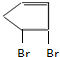 、
、 +Br2→
+Br2→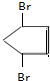 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com