
����Ŀ��NA��ʾ����٤������������˵����ȷ���ǣ� �� 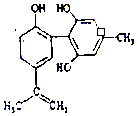
A.��״���£�22.4L HF�к��з�ԭ����ĿΪNA
B.0.1mol/L��NH4HSO4��Һ�еμ�0.1mol/L��Ba��OH��2��Һ�������պ���ȫ��c��NH4+����c��OH������c��SO42������c��H+��
C.1mol ��ͼ������Ũ��ˮ��Ӧʱͨ���������Br2Ϊ6mol
D.12gʯīϩ������ʯī���к�����Ԫ���ĸ���Ϊ0.5NA
���𰸡�D
���������⣺A�������HFΪҺ̬���ʲ��ܸ�������Ħ����������㣬��A����
B��0.1mol/L��NH4HSO4��Һ�еμ�0.1mol/L��Ba��OH��2��Һ�������պ���ȫ�������ߵ����ʵ���֮��Ϊ1��1�����߷�Ӧ���õ���ҺΪ��ˮ��Һ�����õ�BaSO4����������Һ�е�����Ũ��Ϊ��c��OH������c��NH4+����c��H+����c��SO42��������B����
C�����л����к�3��̼̼˫���ͷ��ǻ�����1mol���л�������5mol�壬��C����
D��12gʯī�����ʵ���Ϊ1mol����ʯīϩ��ƽ��ÿ����Ԫ����̼ԭ��2������1mol̼ԭ�Ӻ�����Ԫ���ĸ���Ϊ0.5NA �� ��D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ����������ڱ������λ����ͼ��ʾ����Yԭ�ӵ������������ڲ��������3��������˵����ȷ���ǣ� ��![]()
A.X����̬�⻯���Y���ȶ�
B.W������������Ӧˮ��������Ա�Z��ǿ
C.Z�ķǽ����Ա�Y��ǿ
D.X��Y�γɵĻ����ﶼ������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ���ǣ� ��
A.�ƺ���ˮ��Ӧ��Na+2H2O�TNa++2OH��+H2��
B.��������������������Һ�У�Al+2OH���TAl ![]() +H2��
+H2��
C.����������������2Al+6H+�T2Al3++3H2��
D.Fe��OH��3�����ᷴӦ��OH��+H+�TH2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵����ȷ���ǣ� ��
A.1molCl2�μӷ�Ӧת�Ƶ�������һ��Ϊ2NA
B.��16g18O2���10NA������
C.��״���£�22.4L HF�к�2NA��ԭ��
D.3mol����Fe��ȫת��ΪFe3O4 �� ʧȥ9NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������͵��˵���в���������
A. �ⵥ���ǴӺ�ˮ�д�����ȡ�� B. ��ˮ��ʹʪ��ĵ���KI��ֽ����
C. ���ʵ������� D. ��������һ�������ɫҺ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ��������г��������ʣ���;�㷺����ϳɷ���������Ҳ�����о���ֵ��
I��ֱ���Ҵ�ȼ�ϵ����DEFC�����кܶ��ŵ㣬���������ǵ��о���Ȥ���������������Ҵ�ȼ�ϵ�ء�
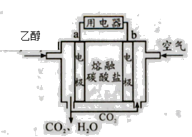
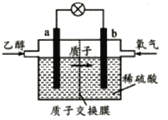

�����Ҵ�ȼ�ϵ�� �����Ҵ�ȼ�ϵ�� �������Ҵ�ȼ�ϵ��
��1�������Ҵ�ȼ�ϵ����������Ӧ���Ϊ____________��
��2�������Ҵ�ȼ�ϵ�������缫a�Ϸ����ĵ缫��ӦʽΪ________________________��ʹ�ÿ���������������ع��������м��Ի���½�����ԭ���� ____________��
��3�������Ҵ�ȼ�ϵ�������缫b�Ϸ����ĵ缫��ӦʽΪ_______________________��ͨ�����ӽ���Ĥ��������___________��
��4���������Ҵ�ȼ�ϵ������ѡ������̼���Ϊ���ʣ���ع���ʱ��CO32����缫____������a������b�����ƶ����缫b�Ϸ����ĵ缫��ӦʽΪ_____________________��
II����֪����ֱ��ˮ�Ϸ�������ȡ�Ҵ���H2O(g) + C2H4(g) ![]() CH3CH2OH(g)����n(H2O)�Un(C2H4)=1�U1ʱ����ϩ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CH3CH2OH(g)����n(H2O)�Un(C2H4)=1�U1ʱ����ϩ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��

��1��ͼ��ѹǿP1��P2��P3��P4�Ĵ�С˳��Ϊ��_________________________�������ǣ�______________��
��2������ֱ��ˮ�Ϸ����õĹ�������Ϊ������/������Ϊ��������Ӧ�¶�290 ����ѹǿ6.9MPa��n(H2O)�Un(C2H4)=0.6�U1������������ϩ��ת����Ϊ5�G����Ҫ��һ�������ϩ��ת���ʣ����˿����ʵ��ı䷴Ӧ�¶Ⱥ�ѹǿ�⣬�����Բ�ȡ�Ĵ�ʩ��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����ʽ����[MgaAlb��OH��c��CO3��dxH2O]��ȼ��������ȼ�����̡����ȹ��ܣ���һ�ֲ�����ˮ����������ȼ����
��1����[MgaAlb��OH��c��CO3��dxH2O]��ʾ����������ʽ��
��2��Ϊȷ��þ����ʽ̼���ε���ɣ���������ʵ�飺
ȷ��ȡ15.050g��Ʒ�������������أ�����CO20.560L���ѻ���ɱ�״���£���������ò�������MgOΪ6.000g��Al2O3Ϊ2.550g��ͨ������ȷ����þ����ʽ̼���εĻ�ѧʽ �� ��д��������̣�
��3����þ����ʽ̼���ο�����MgCl2��NaAlO2��NaOH��Na2CO3��Ӧ�Ʊ����Ʊ��Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[aFe2��SO4��3b��NH4��2SO4cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȣ�ij����������������������������ƣ��������Ϊԭ�ϣ��������ͼ����������ȡ������泥� 
��ش��������⣺
��1������������Һ��H2SO4�ữ����ҪĿ����
��2���������������ʺϵ�������B�� ��
a��NaClO b��H2O2 c��KMnO4 d��K2Cr2O7
��3�������������ǣ��� ��
��4�����������У�����֮��ͼ�������֮ǰ����ȡ���������Լ��Ļ�ѧʽ������Fe2+�Ƿ���ȫ����������
��5����ȡ14.00g������Ʒ����������ˮ���Ƴ�100mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14g����������һ����Һ�м���0.05mol Ba ��NO3��2��Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ����������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ��ǣ� ��
A.SiO2 ![]() SiCl4
SiCl4 ![]() Si
Si
B.FeS2 ![]() SO2
SO2 ![]() H2SO4
H2SO4
C.N2 ![]() NH3
NH3 ![]() NH4Cl��aq��
NH4Cl��aq��
D.MgCO3 ![]() MgCl2��aq��
MgCl2��aq�� ![]() Mg
Mg
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com