
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
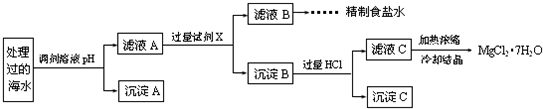


科目:高中化学 来源: 题型:
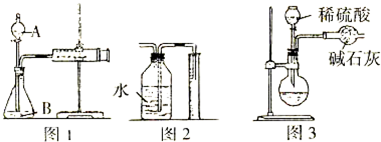
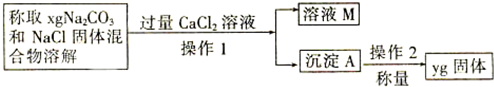
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁强化酱油可通过膳食补充人体所需的铁元素 |
| B、变质的植物油有难闻的特殊气味,是由于植物油发生了水解反应 |
| C、一定浓度的双氧水可用于伤口的消毒 |
| D、蔬菜中含有维生素C,生吃新鲜蔬菜要比熟吃时维生素C的损失大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol/L H2SO4溶液 |
| B、3mol/L CuSO4溶液 |
| C、6mol/L KOH溶液 |
| D、3mol/L Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
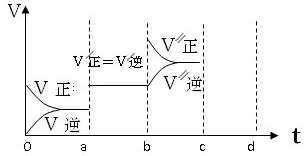 在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:| 物 质 | A | B | C |
| 初始浓度/mol?L-1 | 1.0 | 2.0 | 0 |
| 2min时,平衡浓度/mol?L-1 | 0.4 | 0.2 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 通入O2 |
| 通入空气吹出Br2 |
| 用X吸收 |
| 通入Cl2 |
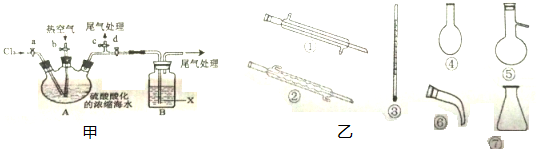
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、过滤操作时,玻璃棒与三层滤纸的一边接触 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、萃取操作时,一般选择有机萃取剂,且萃取剂必须与水不互溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com