
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
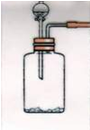
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaCl、AgNO3、NH4Cl、Na2SO4 | B.NaHCO3、H2SO4、KNO3、KOH |
| C.CuSO4、NaCl 、KOH、BaCl2 | D.KNO3、HCl、NaOH、K2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用浓溴水除去苯中混有的苯酚 | B.用重结晶的方法提纯苯甲酸 |
| C.用分液的方法分离乙酸和乙酸乙酯 | D.用浓硫酸除去氨气中混有的水蒸气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 uSO4、K2CO3、NaCl、Na2SO4、K
uSO4、K2CO3、NaCl、Na2SO4、K NO3中的一种或几种,为判断其组成,进行如下实验:①取少量该白色粉末溶于水,产生白色沉淀,上层清液为无色;②取上层清液滴在pH试纸上,pH>7;③过滤,往得到的白色沉淀中滴入稀盐酸,白色沉淀部分溶解。则该白色粉末中一定含有_____________________,一定没有_________,可能含有________________________ 。
NO3中的一种或几种,为判断其组成,进行如下实验:①取少量该白色粉末溶于水,产生白色沉淀,上层清液为无色;②取上层清液滴在pH试纸上,pH>7;③过滤,往得到的白色沉淀中滴入稀盐酸,白色沉淀部分溶解。则该白色粉末中一定含有_____________________,一定没有_________,可能含有________________________ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
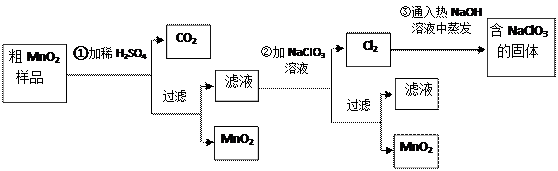
 、 ▲ 、玻璃棒。
、 ▲ 、玻璃棒。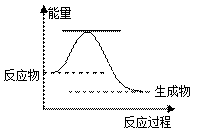
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| B | NH3(H2 O) O) | 浓硫酸 | 洗气 |
| C | KCl固体(I2) | KO H溶液 H溶液 | 加热 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com