
����Ŀ����1����ͼ��ʾ������������ͨ��ʢ�и�����ɫ�����Ĺ��ƿ��ʢ��ʪ����ɫ�����Ĺ��ƿ���ɹ۲쵽��������_______��
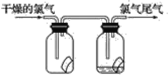
��2��Ϊ��ֹ����β����Ⱦ������ʵ����ͨ����________��Һ���ն����������ԭ����______________________(�û�ѧ����ʽ��ʾ)����ҵ�ϳ������۵�ʯ�������չ�ҵ����β���Ƶ�Ư�ۣ�Ư�۵���Ч�ɷ���________________(�ѧʽ)��Ư������ˮ���ܿ����е�CO2���ã�������Ư�ס�ɱ�����õĴ����ᣬ��ѧ����ʽΪ_____________________������¶���ڿ����е�Ư�ۣ���ϡ����������������________(����ĸ����ͬ)��
A��O2B��Cl2 C��CO2D��HClO
��3��һ����������й©�ͱ�ը�¹ʣ���ΧȺ��Ӧ������ɢ�����������뱬ը�ֳ�ʱ�������ý���һ��Ũ��ij����ˮ��Һ��ë����ס���ӣ������˲��õĸ�������________��
A��NaOH B��NaCl
C��KCl D��Na2CO3
���𰸡��������ɫ��������ɫ��ʪ�����ɫ������ɫ NaOH(����������) Cl2��2NaOH===NaCl��NaClO��H2O Ca(ClO)2 Ca(ClO)2��CO2��H2O===CaCO3����2HClO C D
��������
��1��������Ư���ԣ�������ˮ��Ӧ���ɵĴ��������Ư���ԣ�
��2����������������������Һ��Ӧ������β����ʯ�������չ�ҵ����β���Ƶ�Ư�������Ȼ��ơ�������ƣ���Ӧ�Ļ�ѧ����ʽΪ��2Cl2+2Ca��OH��2=CaCl2 +Ca��ClO��2 +2H2O���������Ca��ClO��2�ܿ����е�CO2��ˮ���ã���������Ư�ס�ɱ�����õĴ������һ�ֳ�������Ӧ�Ļ�ѧ����ʽΪ��Ca��ClO��2+CO2+H2O�TCaCO3��+2HClO��̼��ƺ����ᷴӦ���ɶ�����̼�����Գ���¶���ڿ����е�Ư�ۣ���ϡ���������������Ƕ�����̼��
��3������NaOH��ʴ��ǿ������ü�������Na2CO3����ʡ�
(1)���������������Ư���ԣ�������ˮ��Ӧ���ɵĴ�����ž���Ư���ԣ��������ɫ��������ɫ��ʪ�����ɫ������ɫ���������ɫ��������ɫ��ʪ�����ɫ������ɫ��
(2)Ϊ�˷�ֹ����β����Ⱦ����������NaOH��Һ���գ��÷�Ӧ�Ļ�ѧ����ʽΪCl2+2NaOH=NaCl+NaClO+H2O�����ӷ�ӦΪCl2+2OH��=Cl��+ClO��+H2O��Ư������ˮ���ܿ����е�CO2���ã�������Ư�ס�ɱ�����õĴ����ᣬ��ѧ����ʽΪCa(ClO)2��CO2��H2O=CaCO3����2HClO��Ư�۳���¶���ڿ����л��������CaCO3����ϡ��������CO2���壻
�ʴ�Ϊ��NaOH��Cl2+2NaOH=NaCl+NaClO+H2O��Ca(ClO)2 ��Ca(ClO)2��CO2��H2O=CaCO3����2HClO��C��
��3�������ܹ���Ӧ������NaOH��ʴ��ǿ������ü�������Na2CO3����ʣ���ѡD��


 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС��ͬѧ��������ˮ�п��ܺ��д���Ca2����Mg2����ijЩ�����ӣ��Ӷ�����������ʵ�飺
��ȡ��������ˮ���Թ��У��μ�������NaOH��Һ��������ɫ������
�ڹ��˺�ȡ��Һ���Թ��У��μ�������Na2CO3��Һ�����а�ɫ�������ɣ�
����ȡ��������ˮ���Թ��У��μ�����ϡ������ٵμ�AgNO3��Һ��Ҳ������ɫ������
��ش��������⣺
(1) ͨ��ʵ��ɳ���ȷ������ˮ��________(����������������������)����Ca2����Mg2����
(2) ����ˮ�����������ӿ���ȷ����___________����������AgNO3��Һ������Ӧ�����ӷ���ʽΪ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MnO2��Zn��������ͨ�ɵ�ص���Ҫԭ�ϣ��������̿�(��Ҫ�ɷ�ΪMnO2)����п��(��Ҫ�ɷ�ΪZnS)�Ʊ�MnO2��Zn�Ĺ���������ͼ������˵��������ǣ� ��
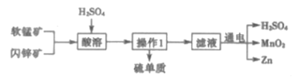
A.�ɵ����һ�ֽ���ѧ��ת��Ϊ���ܵ�װ��
B.ԭ���������ѭ��ʹ�ã��ҿ���������������������
C.����ʱZnS����ԭ��������1Ϊ����
D.ͨ����ʱMnO2�����������ɣ��缫��ӦΪ��Mn2+-2e-+2H2O=MnO2+4H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѽ��仯����Ӧ�ù㷺��
(1)(��Ԫ�ػ�̬ԭ�Ӻ����������ӵ�����״̬___��������ͬ�������෴������
(2)��֪һ��������TiO2��TiCl4֮������ת����TiO2![]() TiCl4��
TiCl4��
��Ti��Cl��O����Ԫ�ص縺���ɴ�С��˳��Ϊ___��
��COCl2�ķ��ӹ���Ϊ___�����Ǵ�С�Ƚϡ�Cl��C��O___��C1��C��Cl������>������<������������������Ŀ֮��Ϊ___��
����֪������TiCl4Ϊ��ɫ�������Ҵ���Һ�壬��TiCl4�ľ�������Ϊ___��
��3�������[TiCl(H2O)5]Cl2��H2O�У��������ӵ���λ����___����1mol��������м�������AgNO3��Һ�����Եõ�___molAgCl������
��4�����ʯ��TiO2�ľ���(��=��=��=90o)��ͼ��ʾ��TiO2������Oԭ�ӵ���λ����___���侧������Ϊ��a=b=459pm��c=295pm���þ����ܶ�Ϊ___g/cm3���г�����ʽ����
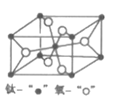
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʵ�����������������ȷ���ǣ� ��
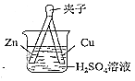
A.��Һ����ɫB.Cu Ƭ��������
C.Zn ��������D.Cu ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����淴ӦA(g)��3B(g) ![]() 2C(g)���ﵽƽ��ı�־��
2C(g)���ﵽƽ��ı�־��
A.C���ɵ�������C�ֽ���������
B.A��B��C��Ũ�����
C.��λʱ��������n molA��ͬʱ����2nmol C
D.��λʱ��������n molA��ͬʱ����3nmol B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ���ã�5gҺ̬�״�(CH3OH)�������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�113��5kJ����������д���״�ȼ�յ��Ȼ�ѧ����ʽ____________________________________��
��2����֪��ӦN2+3H2![]() 2NH3 ��H=akJ/mol���Ը����±������м������ݹ���a����ֵΪ______��
2NH3 ��H=akJ/mol���Ը����±������м������ݹ���a����ֵΪ______��
��ѧ�� | H-H | N-H | N��N |
����kJ/mol | 436 | 391 | 945 |
��3�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣
��֪��C(s��ʯī)+O2(g)=CO2(g) ��Hl=-393. 5kJ/mol
2H2(g)+O2(g)=2H2O(l) ��H2=-571.6kJ/mol
2C2H2(g) +5O2(g) =4CO2(g) +2H2O(1) ��H3=-2599kJ/mol
���Ƹ�˹���ɣ�����298Kʱ��C(s,ʯī)��H2(g)����1mol C2H2(g)��Ӧ�Ȼ�ѧ����ʽ:__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������ʵ�����Ʊ���ˮ FeCl3 ���õ������� FeCl3 ��Һ�����������ϵ�֪����ˮ FeCl3 �ڿ������׳��⣬��������������ͼ������Ƶ�ʵ��װ��ͼ�����ȼ��г�װ����ȥ��
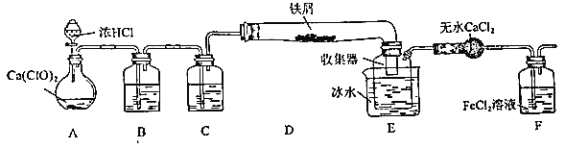
���������գ�
��1��װ�� A �� Cl2 ����װ�ã����еĻ�ѧ��Ӧ����ʽΪ_____
��2��B �е���Һ��_____��C ��������_____
��3��D ���Ⱥ��������� FeCl3 ������D ���Ҷˣ�Ҫʹ������ FeCl3 ����E��������______________
E �б�ˮ������Ϊ_____
��4��ʵ��Ա��ʦ������װ������� 2 ��Ľ����飺һ��װ�����Ӳ��ֶ��ijɱ������ӿڣ����������Ӽ���ԭ����_____����������װ�û�����һ���ܴ��ȱ�ݣ��Ľ��ķ�����_______________
��5��֤�� F�� FeCl2 δ����ȫ�����ķ�����_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2 L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ��
(1)���Һ�У�NaCl�����ʵ���Ϊ_______mol��MgCl2������Ϊ_______g��
(2)�û����Һ��CuCl2�����ʵ���Ũ��Ϊ_____molL��1�����û����Һ��ˮϡ�������Ϊ1 L��ϡ�ͺ���Һ��Cu2+�����ʵ���Ũ��Ϊ_______molL��1��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com